
 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO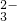 、SO
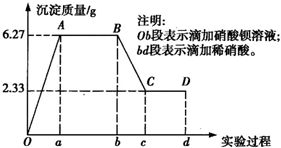
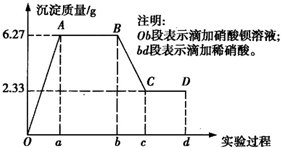
、SO 、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如右图所示:
、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如右图所示: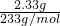 =0.01mol,n(CO32-)=n(BaCO3)=
=0.01mol,n(CO32-)=n(BaCO3)= =0.02mol;c(SO42-):c(CO32-)=1:2;原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.6mol/L;
=0.02mol;c(SO42-):c(CO32-)=1:2;原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.6mol/L; =0.02mol;消耗稀硝酸物质的量为0.04mol,消耗硝酸的体积=
=0.02mol;消耗稀硝酸物质的量为0.04mol,消耗硝酸的体积=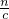 =
= =0.04L=40ml,故答案为:40ml;
=0.04L=40ml,故答案为:40ml;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com