
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中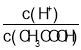 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.将0.1mol/L的NaOH的温度提高至80℃,溶液的pH变小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】5—羟色胺对人体睡眠具有调节作用,其结构简式如右图所示。下列有关5—羟色胺说法正确的是
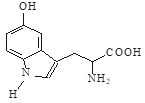
A.该有机物分子式为C11H11N2O3
B.该有机物既能和NaOH反应,也能和HCl反应
C.该有机物分子中无手性碳原子
D.1mol该物质最多可消耗溴水中2mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应速率和化学平衡、溶液pH影响的图像,其中图像和实验结论表达均正确的是

A.①是其他条件一定时,反应速率随温度变化的图像,正反应△H<0
B.②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是表示Cl2通入H2S溶液中pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素的元素符号_____、_____、_____。
(2)C在元素周期表中的位置是_____。
(3)B的原子结构示意图为_____,C的氢化物与B的氢化物的稳定性强弱顺序为_____(填化学式)。
(4)比较A、C的原子半径:A_____C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是( )
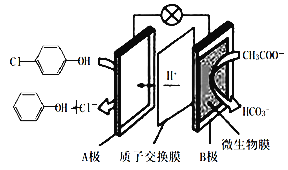
A.本装置集净化、供电于一体,产物之一还有消毒作用
B.每消耗1mol CH3COO-,通过质子交换膜的质子的物质的量为8mol
C.在该装置中,B极上的电势比A极上的电势高
D.A极的电极反应为![]() +H++2e-→
+H++2e-→![]() +Cl-
+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示
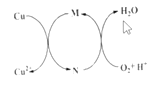
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硫酸中的一步重要反应是SO2在400~500。C下的催化氧化2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是
A.通过调试反应条件,可以提高该反应的进行程度
B.使用催化剂的目的是加快反应速率,提高生产效率
C.达到平衡时,SO2和SO3的速率相等
D.提高反应温度,可以实现SO2的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为![]() 和
和![]() 反应生成
反应生成![]() 过程中的能量变化,下列说法中正确的是
过程中的能量变化,下列说法中正确的是
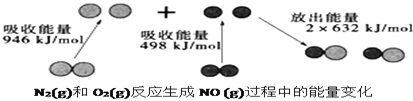
A.![]() 和
和![]() 完全反应放出的能量为180kJ
完全反应放出的能量为180kJ
B.通常情况下,![]() 和
和![]() 混合能直接生成NO
混合能直接生成NO
C.![]() 和
和![]() 具有的总能量小于
具有的总能量小于![]() 具有的总能量
具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com