
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
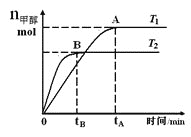
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
【题目】依据事实,按要求填空:
(1)在25℃、101kPa下,1mol乙醇燃烧生成CO2和液态水时放热1269.6kJ.则表示乙醇燃烧热的热化学方程式为______.
(2)已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为______.
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=______kJmol﹣1.
(4)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
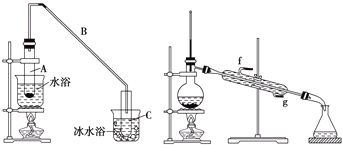
【题目】化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知: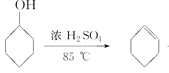 +H2O
+H2O
密度 | 熔点 | 沸点 | 溶解性 | |
环己醇 |
| 25 | 161 | 能溶于水 |
环己烯 |
|
| 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
导管B除了导气外还具有的作用是______。
②试管C置于冰水浴中的目的是______。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等![]() 加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液![]() 稀H2SO4 C.Na2CO3溶液
稀H2SO4 C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从______口进入![]() 填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
③收集产品时,控制的温应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是_____。
A.蒸馏时从![]() 开始收集产品
开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是______。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2SO2+O2![]() 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
A. Qc不变,K变大,O2转化率增大 B. Qc不变,K变大,SO2转化率减小
C. Qc变小,K不变,O2转化率减小 D. Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
A、容器内气体密度保持不变
B、容器内温度不再变化
C、断裂1mol N≡N键的同时,生成6mol N﹣H键
D、反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol
②2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H=________ kJ/mol。
(3)已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g)△H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________。
(4)在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ = Y-+ 3S↓+ 3H2O
①YO3n-中Y的化合价是_____________;
②Y元素原子的最外层电子数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等,下列判断不正确的是
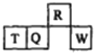
A. 最简单气态氢化物的热稳定性:R>Q B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R D. 含T的盐溶液一定能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度为0.1mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1、b mol·L-1、cmol·L-1,大小顺序为 ______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,生成的盐的物质的量依次为n1mol、n2mol、n3mol,它们的大小关系为 ______。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3 L,其大小关系为 ______。
(4)与等量锌反应时产生氢气![]() 的速率分别为v1、v2、v3,其大小关系为 ______。
的速率分别为v1、v2、v3,其大小关系为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
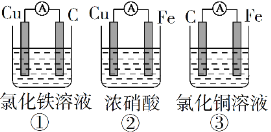
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
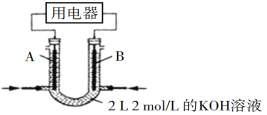
实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com