
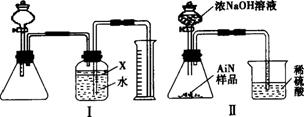
(1)实验有关操作为:a.往锥形瓶中放入适量的AlN样品;b.从分液漏斗往锥形瓶中加入过量的浓NaOH;c.检查装置的气密性;d.测定收集到水的体积。正确的操作顺序为_____________。
(2)本试验中检查装置气密性的方法是______________。
(3)广口瓶中的试剂X可选用___________(填选项序号)。
A.汽油 B.酒精 C.植物油 D.四氯化碳
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将____________(填“偏大”“偏小”或“不变”)。
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是__________________。
(6)若实验中测得样品的质量为w g,氨气的体积为a L(标准状况),则样品中AlN的质量分数为_______________(AlN的相对分子质量为41)。
(7)有人改用图Ⅱ装置进行同样的实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为是否可行____________(填“可行”或“不可行”),原因是_________________,改进的方法是___________________________________________________________________。
【解析】(1)正确的操作顺序为c(检查装置的气密性)→a(往锥形瓶中放入适量的AlN样品)→b(从分液漏斗往锥形瓶中加入过量的浓NaOH)→d(测定收集到水的体积)。
(2)检查装置的气密性,在本题中可以这样操作:向量筒中加入适量的水,直至把导管的下端浸没在水面下,关闭分液漏斗的活塞,微热锥形瓶,如果能观察到广口瓶右边的长导管中形成一段水柱,量筒内的导管口有气泡产生,说明装置的气密性良好。
(3)用排水法测定气体的体积,通常只适用于难溶于水的气体,本题中产生的NH3是极易溶于水的,需要对装置进行某方面的“特殊处理”(即在瓶内的水面上加一层“保护膜”,防止NH3直接与水接触)。因为汽油易挥发,酒精易溶于水,四氯化碳密度比水大而沉于水底,植物油比水轻浮在水面上且不易挥发,选C。
(4)如果广口瓶中的液体没装满,上方空间有少量空气,对实验结果没有影响,因为实验原理是让产生的气体将广口瓶中的水排出,最终是通过测量量筒里水的体积来确定气体体积,如果广口瓶内上方空间预先有空气,实验结束后,装置内仍有气体,同温同压下其气体体积相同,实验过程中排出水的体积不会受到影响。
(5)样品中的AlN和Al2O3都能溶于NaOH溶液生成NaAlO2溶液,最终留下的固体是碳。
(6)根据关系式AlN—NH3↑,可以直接求出样品中AlN的质量分数为:w(AlN)=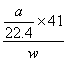 ×100%=
×100%=![]() %。
%。
(7)不可行,因为NH3极易被水(或硫酸)吸收产生液体倒吸现象(说明:如果烧杯中的硫酸溶液一旦倒吸进入左边的锥形瓶内,就不能再用测定烧杯中硫酸溶液增重的方法来测定样品中AlN的质量分数了!)。最后一问,是一道开放性的设计,能充分考查学生的创新能力,只要原理正确,操作简单,答案合理就行,例如,改进方法:在烧杯内的导管末端连一个倒置的漏斗,使漏斗的边缘刚好浸没在硫酸中(或其他合理答案)。
【答案】(1)cabd (2)向量筒中加入适量的水,直至把导管的下端浸没在水面下,关闭分液漏斗的活塞,微热锥形瓶,如果能观察到广口瓶右边的长导管中形成一段水柱,量筒内的导管口有气泡产生,说明装置的气密性良好。(3)c (4)不变 (5)碳 (6)![]() % (7)不可行,因为NH3极易被水(或硫酸)吸收产生液体倒吸现象(说明:如果烧杯中的硫酸溶液一旦倒吸进入左边的锥形瓶内,就不能再用测定烧杯中硫酸溶液增重的方法来测定样品中AlN的质量分数了!)。改进方法:在烧杯内的导管末端连一个倒置的漏斗,使漏斗的边缘刚好浸没在硫酸中(或其他合理答案)。
% (7)不可行,因为NH3极易被水(或硫酸)吸收产生液体倒吸现象(说明:如果烧杯中的硫酸溶液一旦倒吸进入左边的锥形瓶内,就不能再用测定烧杯中硫酸溶液增重的方法来测定样品中AlN的质量分数了!)。改进方法:在烧杯内的导管末端连一个倒置的漏斗,使漏斗的边缘刚好浸没在硫酸中(或其他合理答案)。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:阅读理解

图Ⅰ
(1)实验有关操作为:
a.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入水和X液体
b.从分液漏斗往圆底烧瓶中加入一定体积的过量的浓NaOH溶液
c.检验装置的气密性
d.读取收集到水的体积
正确的操作顺序为______________________。
(2)本实验中检查装置气密性的方法是________________________。
(3)广口瓶中的试剂X可选用___________(填选项的标号)。
A.丁烷 B.酒精 C.植物油 D.CCl4
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是________________。
(5)实验结束后,分液漏斗中的NaOH溶液已经全部加入烧瓶,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中的AlN的质量分数为___________(AlN的式量为41),这一测定结果比实际值偏高,你认为可能的原因是__________________________。
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为这样的改进是否可行?________________(填“可行”或“不可行”)。理由是________________________。
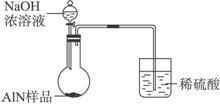
图Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ装置来进行实验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O====NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
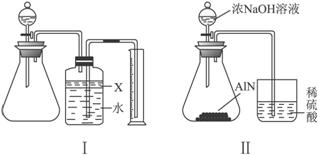
(1)实验有关操作为:
A.往锥形瓶中放入适量的AlN样品 b.从分液漏斗往锥形瓶中加入过量的浓NaOH
c.检验装置的气密性 d.测定收集到水的体积
正确的操作顺序为___________________________。
(2)本实验中检查装置气密性的方法是__________________。
(3)广口瓶中的试剂X应选用_________(填选项的编号)。
A.汽油 B.酒精 C.植物油 D.CCl4
(4)广口瓶内的液体没有装满(上方留有少量空间),实验测得NH3的体积将_________(填“偏大”“偏小”或“不变”)。
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是_________。
(6)若实验中测得样品的质量为wg,氨气的体积为a L(标况下),则样品中AlN的质量分数为_________(AlN的式量为41)。
(7)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中A1N的质量分数。你认为是否可行?_________(填“可行”或“不可行”)。原因是_________,改进的方法为_________(若认为“可行”,此空格不需回答)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省莆田市高三3月质量检测化学试卷(解析版) 题型:实验题
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有趾Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(
(4)为测定生成气体的体积,量气装置中的X液体可以是_________________________。
a.CCl4????????? b.H2O???? c.NH4Cl溶液??? d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数__。
【方案3】按以下步骤测定样品中A1N的纯度:

(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Al2O3+![]() 2AlN+3CO
2AlN+3CO
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。
(1)根据氮化铝的制取原理,推测某氮化铝中所含杂质可能是__________(有几种就写几种)。
(2)某同学现用图Ⅰ中的一些装置来测定氮化铝的质量分数,使氮化铝样品和NaOH溶液反应生成NaAlO2,并放出氨气。根据反应中所生成氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)

图5-2
①写出氧化铝与NaOH溶液反应的化学方程式:______________________________。
②本试验中检查图I中装置气密性的方法是_________________________________。
③广口瓶中的试剂X最好选用___________(填选项的标号)
A.苯 B.酒精 C.植物油 D.CCl4
④广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将___________(填“偏大”、“偏小”或“不变”)
⑤若实验中测得样品的质量为10.
⑥实验结束后,若观察到锥形瓶中还有固体,则样品中的杂质含___________,为了测定是否还有其他杂质,则还需要哪些简单数据:___________。
⑦该同学实验方案,可能因气体体积测量不准,导致误差较大。有人建议改用图5-2Ⅱ中乙、丙两个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测定,可比较准确地确定样品中AlN的质量分数。较合理的装置是:___________(填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com