
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )| A. | N4与N2互称为同位素 | |
| B. | N4属于一种新型的化合物 | |
| C. | N4化学性质比N2稳定 | |
| D. | 1mol N4气体转化为N2时要放出882kJ能量 |
分析 A.根据同位素的定义分析,同位素是指同一元素的不同原子;
B.N4属于一种元素组成的单质;
C.根据键能分析,键能越大键越牢固,分子越稳定;
D.根据结构特点结合化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较.
解答 解:A.N4与N2为单质,同一元素的不同单质互为同素异形体,所以它们是同素异形体,而不是同位素,故A错误;
B.N4由N组成,是一种单质,而化合物是由不同元素组成的纯净物,故B错误;
C.根据键能分析,键能越大键越牢固,分子越稳定,断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,所以N2化学性质比N4稳定,故C错误;
D.从结构图中可看出,一个N4分子中含有6个N-N键,根据N4(g)=2N2(g)有1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为:6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为:1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D正确;
故选D.
点评 本题考查了反应热计算、同位素、分子稳定性与键能间的关系等知识,题目难度不大,注意基础知识的把握.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题: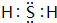 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3分子中存在极性共价键 | |
| B. | P-H键键长比N-H键键长长 | |
| C. | PH3沸点低于NH3沸点,因为P-H键键能低 | |
| D. | PH3分子稳定性低于NH3分子,因为N-H键键能高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a(A-N+3)}{A+3}$ | B. | $\frac{a(A-N+8)}{A+16}mol$ | ||
| C. | $\frac{a(2A-2N+40)}{2A+90}$ | D. | $\frac{2A-2N+24}{2A+54}mol$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com