
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1
NH2CO2NH4(s) △H1= -159.5kJ·mol-1
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1
则反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) △H=______kJmol-1
CO(NH2)2(s)+H2O(l) △H=______kJmol-1
(2)将氨气与二氧化碳在有催化剂的反应器中反应2NH3(g)+CO2(g)![]() CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
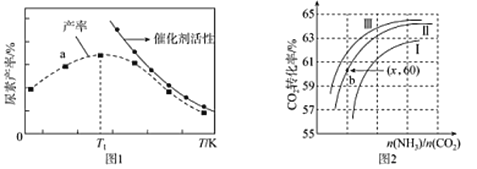
①a点_______(填是或不是)处于平衡状态,Tl之后尿素产率下降的原因是________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比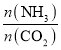 、水碳比
、水碳比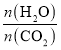 的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是___________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10一b。
N2H62++OH- K2=1×10一b。
①25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_____。
【答案】-87.0 不是 升高温度反应逆向移动,催化剂活性降低 I 4 K=![]() 14-b<pH<14-a N2H5HSO4
14-b<pH<14-a N2H5HSO4
【解析】
(1)反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1 ③
利用盖斯定律,将①+②-③,即得反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)的△H。
CO(NH2)2(s)+H2O(l)的△H。
(2)①在T1之后,升高温度,尿素的产率降低,说明平衡逆向移动,正反应为放热反应。也就是温度越高,达平衡时氨的转化率越低,若a点达平衡,则氨的产率比T1点大。
②对于反应体系,在氨碳比相同的情况下,增大水蒸气的量,平衡逆向移动,CO2的转化率降低。对于b点,氨的转化率为30%,CO2的转化率为60%,由变化量之比等于化学计量数之比,可求出x。
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡时,v(正)= v(逆),由此可求出平衡常数K与k(正)、k(逆)的关系式。
(3) K1=![]() =1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a;K2=
=1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a;K2=![]() =1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,由此可求出应控制溶液pH范围。
=1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,由此可求出应控制溶液pH范围。
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成硫酸氢盐,由此可得出该盐的化学式。
(1)反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1 ③
利用盖斯定律,将①+②-③,即得反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)的△H= -87.0 kJmol-1。答案为:-87.0;
CO(NH2)2(s)+H2O(l)的△H= -87.0 kJmol-1。答案为:-87.0;
(2)①在T1之后,升高温度,尿素的产率降低,说明平衡逆向移动,正反应为放热反应。也就是温度越高,达平衡时氨的转化率越低,若a点达平衡,则氨的产率比T1点大。所以a点不是处于平衡状态,Tl之后尿素产率下降的原因是升高温度反应逆向移动,催化剂活性降低。答案为:不是;升高温度反应逆向移动,催化剂活性降低;
②对于反应体系,在氨碳比相同的情况下,增大水蒸气的量,平衡逆向移动,CO2的转化率降低,从而得出曲线I、II、III对应的水碳比最大的是I。对于b点,氨的转化率为30%,CO2的转化率为60%,由变化量之比等于化学计量数之比可得,![]() ,可求出x=
,可求出x=![]() =4。答案为:I;4;
=4。答案为:I;4;
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡时,v(正)= v(逆),k(正)c2(NH3)c(CO2)=k(逆)c(H2O),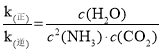 =K。答案为:K=
=K。答案为:K=![]() ;
;
(3) K1=![]() =1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a,则pH<14-a;K2=
=1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a,则pH<14-a;K2=![]() =1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,pH>14-b,由此可求出应控制溶液pH范围为14-b<pH<14-a。答案为:14-b<pH<14-a;
=1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,pH>14-b,由此可求出应控制溶液pH范围为14-b<pH<14-a。答案为:14-b<pH<14-a;
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成硫酸氢盐,由此可得出该盐的化学式为N2H5HSO4。答案为:N2H5HSO4。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
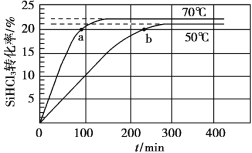
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H >0
Z(g)+W(s);△H >0
下列叙述正确的是
A. 减少少量W,逆反应速率减小
B. 当容器中气体的平均摩尔质量不变时,反应达到平衡
C. 降低温度,平衡正向移动
D. 平衡后加入Z,上述反应的△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
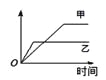
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A.常温常压下,2 g D2O 中含中子数为NA
B.1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4 NA
)分子中含有碳碳双键的个数为4 NA
C.0.5mol羟基中所含电子数为4.5NA
D.28g乙烯和丙烯(C3H6)的混合气体含有的碳原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分属周期表前三周期的四种元素W、X、Y、Z可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( )
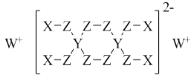
A.在该物质中,Y的化合价为+4价
B.X和Z可以形成具有强氧化性的化合物
C.由Z和W形成的化合物中可以存在共价键
D.X、Y、Z的原子半径从大到小为Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
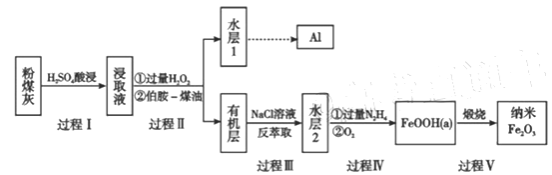
已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_________。
(2)写出过程II加入过量H2O2发生的离子方程式_________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_________。
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理________。
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。
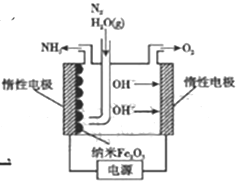
已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为_________。纳米Fe2O3在电解过程中所起的作用是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com