
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)
(2)碳与水蒸气反应制取H2的相关反应如下
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
【答案】0.3mol/(L·min)B-90.3K1·K2·K3A
【解析】
(1)①从反应开始到5min,图象可知CO难度变化为2.00mol/L-0.50mol/L=1.50mol/L,反应速率v=![]() ;②A.结合三行计算列式计算,转化率=
;②A.结合三行计算列式计算,转化率=![]() ×100%;B.反应前后气体质量不变,气体物质的量变化,达到平衡状态平均相对分子质量不变;C.达到平衡后,再充人氩气,总压增大分压不变,速率不变;D.2min前后v(正)>v(逆);
×100%;B.反应前后气体质量不变,气体物质的量变化,达到平衡状态平均相对分子质量不变;C.达到平衡后,再充人氩气,总压增大分压不变,速率不变;D.2min前后v(正)>v(逆);
①从反应开始到5min,图象可知CO难度变化为2.00mol/L-0.50mol/L=1.50mol/L,从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=![]() =0.3mol/(Lmin);②A.结合三行计算列式计算,
=0.3mol/(Lmin);②A.结合三行计算列式计算,
CO(g)+2H2(g)![]() CH3OH(g),
CH3OH(g),
起始量 2 4 0
变化量 1.5 3 1.5
平衡量 0.5 1 1.5
达到平衡时,H2的转化率=![]() ×100%=
×100%=![]() ×100%=75%,选项A错误;B.反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,选项B正确;C.达到平衡后,再充人氩气,总压增大分压不变,速率不变,选项C错误;D.2min前后反应未达到平衡状态,反应正向进行,v(正)>v(逆),选项D错误;答案选B;(2)①已知Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.0kJ/mol;Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H2= - 43kJ/mol;Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H3= - 178.3kJ/mol;根据盖斯定律,由Ⅰ+Ⅱ+Ⅲ得反应C(s)+2H2O(g)+CaO(s)
×100%=75%,选项A错误;B.反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,选项B正确;C.达到平衡后,再充人氩气,总压增大分压不变,速率不变,选项C错误;D.2min前后反应未达到平衡状态,反应正向进行,v(正)>v(逆),选项D错误;答案选B;(2)①已知Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.0kJ/mol;Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H2= - 43kJ/mol;Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H3= - 178.3kJ/mol;根据盖斯定律,由Ⅰ+Ⅱ+Ⅲ得反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g) △H= △H1+△H2+△H3=+131.0kJ/mol - 43kJ/mol - 178.3kJ/mol =-90.3kJ/mol;②反应C(s)+2H2O(g)+CaO(s)
CaCO3(s)+2H2(g) △H= △H1+△H2+△H3=+131.0kJ/mol - 43kJ/mol - 178.3kJ/mol =-90.3kJ/mol;②反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g) △H=-90.3kJ/mol,A.降低体系的温度,平衡正向移动,氢气的产率增大,选项A正确;B.压缩容器的体积,平衡不移动,氢气的产率不变,选项B错误;C.增加CaO的量,平衡不移动,氢气的产率不变,选项C错误;D.选用适当的催化剂,平衡不移动,氢气的产率不变,选项D错误。答案选A。
CaCO3(s)+2H2(g) △H=-90.3kJ/mol,A.降低体系的温度,平衡正向移动,氢气的产率增大,选项A正确;B.压缩容器的体积,平衡不移动,氢气的产率不变,选项B错误;C.增加CaO的量,平衡不移动,氢气的产率不变,选项C错误;D.选用适当的催化剂,平衡不移动,氢气的产率不变,选项D错误。答案选A。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】X2气和Y2气共100mL,一定条件下使它们充分反应,恢复到原状况时,发现体积仍是100mL,这说明
A.X2气过量B.X2气Y2气各50mL
C.产物是双原子分子D.无法作出上述判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u能使品红溶液退色,v的俗名叫烧碱。上述物质的转化关系如图所示。下列说法正确的是( )
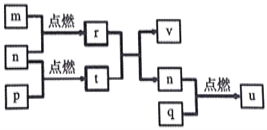
A. 原子半径的大小:W>Z>Y>X
B. t与r反应时,r为氧化剂
C. 生活中可用u使食物增白
D. Z分别与Y、W组成的化合物中化学健类型可能相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素,它们的原子序数依次增大。其中A与C、B与E分别同主族。B、E两元素原子核内质子数之和是A、C之和的2倍。C、D、E 三种元素对应的最高价氧化物的水化物间两两皆能反应。
请回答:
(1)元素B的名称________,E在周期表中的位置为__________________.
(2)写出B、C两元素所形成的原子个数比为1:1的化合物的电子式______,该化合物中存在的化学键有__________________(选离子键、极性键或非极性键)。
(3)C、D两元素对应的最高价氧化物的水化物发生反应的离子方程式为_____________________
(4)下列选项中,可以验证B、E两元素非金属性强弱的是_______(填序号)。
①比较两种元素常见单质的熔点
②比较两种元素的单质与氢气化合的难易程度
③比较两种元素对应氢化物的水溶液的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列物质所含分子数最少的是
A. 标准状况下4.48L二氧化碳 B. 3.2g氧气
C. 含0.4NA个分子的氢气 D. 0.5mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是一个四肽,它可看作是4个氨基酸缩合掉3个水分子而得
![]()
式中R、R’、R”、R’”可能是相同或不同的烃基,或有取代基的烃基,—NH—CO—称为肽键。今有一个多肽,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:甘氨酸(NH2 –CH2—COOH)、丙氨酸[CH3—CH(NH2) —COOH]、苯丙氨酸C6H5—CH (NH2) —COOH、谷氨酸[ HOOC-CH2-CH2-CH(NH2 )-COOH]。问:
(1)这个多肽是几肽______?
(2)该多肽水解后,有几个谷氨酸______?
(3)该多肽水解后,有几个苯丙氨酸______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经测定谷氨酸的同系物——天门冬氨酸中含氧百分率为48.1%,若用0.01mol天门冬氨酸与足量盐酸反应,将所得的盐配成100mL溶液,取10mL用0.2mol/L烧碱溶液滴定,当完全反应时耗碱液15mL。则天门冬氨酸的相对分子质量为______________,分子式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后乙烯和乙烷充分燃烧,得到一氧化碳和二氧化碳的混合气体和45g水。
(1)一氧化碳和二氧化碳的混合气体总物质的量是_____,生成水的物质的量是____。
(2)当a=1时,乙烯和乙烷的物质的量之比是________。
(3)当a=1,且反应后一氧化碳和二氧化碳混合气体的物质的量是反应前氧气的2/3时,则b等于______,得到的一氧化碳和二氧化碳的物质的量之比是_____。
(4)a的取值范围是________,b的取值范围是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com