
| 物质 | 选用试刘 | |
| A | NaBr溶液(NaI) | 溴水 |
| B | CuCl2溶液(FeCl3) | 铜粉 |
| C | 乙烷(乙烯) | 氢气 |
| D | 溴苯(苯) | 液溴 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:多选题
| A. | 乙炔 | B. | 1,3-丁二烯 | C. | 环己烷 | D. | 乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
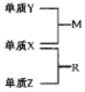 X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为1:1的化合物 | |
| C. | X、Y、Z元素形成的单质均具有强还原性 | |
| D. | R的沸点高于M的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.
铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.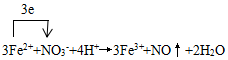 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
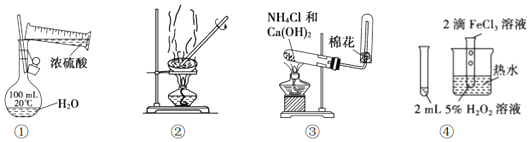
| A. | 用装置①配制一定浓度的硫酸溶液 | |
| B. | 用装置②分离溶解在CCl4中的 I2 | |
| C. | 用装置③制备和收集少量 NH3 | |
| D. | 用装置④验证FeCl3对 H2O2分解有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 酸性:H2SO4>H2SiO3 | ||
| C. | 稳定性:HCl>HBr | D. | 同浓度溶液的碱性:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
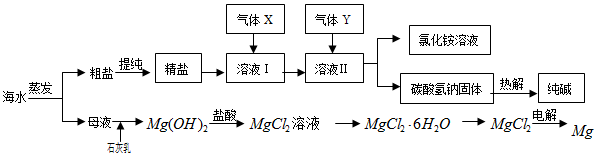
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com