
【题目】高氯酸铜易溶于水,在130'℃时会发生分解反应,是一种燃烧催化剂,以食盐等为原料制备高氯酸铜 [ Cu(ClO4)26 H2O) ]的一种工艺流程如下:
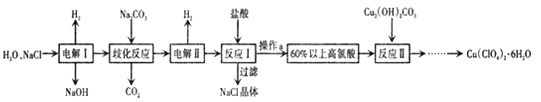
回答下列问题
(1)“电解I”的化学方程式为_________,所用交换膜是_(填“阳离子交换膜或“阴离子交换膜”) 。
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为_。
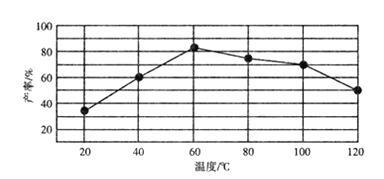
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是______。
(3)“电解II”的阳极产物为 ______(填离子符号).
(4) 该流程中可循环利用的物质是 _________(填化学式) 。
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2 6 H2O为b千克.则产率为_____(用含a、 b 的代数式表示) 。
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2![]() CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
【答案】2NaCl+2 H2O ![]() 2NaOH+H2↑+Cl2↑ 阳离子交换膜 3Na2CO3+3Cl2 = 5NaCl+NaClO3+3CO2 60℃ ClO4- NaCl (702b/371a)×100% 2 Cu(ClO4)2
2NaOH+H2↑+Cl2↑ 阳离子交换膜 3Na2CO3+3Cl2 = 5NaCl+NaClO3+3CO2 60℃ ClO4- NaCl (702b/371a)×100% 2 Cu(ClO4)2 ![]() 2Cu O+7O2↑+2Cl2↑
2Cu O+7O2↑+2Cl2↑
【解析】
以食盐为原料制备高氯酸铜[Cu(ClC4)2·6H2O)],则生成产物为高氯酸钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气,“歧化反应”时,高氯酸钠与碳酸钠溶液发生歧化反应,生成的产物之一为氯酸钠,同时生成二氧化碳气体,通电电解,溶液其中氯酸根离子失电子发生氧化反应生成高氯酸根离子,加入盐酸,过滤除去氯化钠晶体,得到60%以上的高氯酸,“反应Ⅱ”阶段,Cu2(OH)2CO3与HClO4反应经过一系列操作后得到蓝色Cu(C1O4)2溶液,据此分析解答。
(1)根据上述分析可知,反应Ⅰ为电解氯化钠溶液生成氢氧化钠、氢气和氯气,反应的化学方程式为2NaCl+2 H2O ![]() 2NaOH+H2↑+Cl2↑,反应过程中需要防止氢氧根离子与氯气反应,所用的交换膜是阳离子交换膜,故答案为:2NaCl+2 H2O
2NaOH+H2↑+Cl2↑,反应过程中需要防止氢氧根离子与氯气反应,所用的交换膜是阳离子交换膜,故答案为:2NaCl+2 H2O ![]() 2NaOH+H2↑+Cl2↑;阳离子交换膜;
2NaOH+H2↑+Cl2↑;阳离子交换膜;
(2)①“歧化反应”是氯气反应生成氯化钠和NaClO3,氯元素从0价目变为-1价和+5价,同时生成二氧化碳,反应的化学方程式为3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2,故答案为:3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2;
②根据图中信息可知,“歧化反应”阶段在60℃时,产率达最高80%,故答案为:60℃;
(3)通过电解,溶液中氯酸根离子失电子发生氧化反应在阳极生成高氯酸根离子,“电解Ⅱ”的阳极氯离子失电子产物为ClO4-,故答案为:ClO4-;
(4)由上述分析可知,该流程中可循环利用的物质是NaCl,故答案为:NaCl;
(5)根据流程图,氯化钠电解生成的氯气与碳酸钠生成氯酸钠和氯化钠,电解后氯酸钠变成高氯酸钠,加入盐酸反应生成高氯酸,最后与Cu2(OH)2CO3反应生成Cu(ClO4)2·6H2O,假设起始是氯化钠为6mol,则生成的氯气为3mol,得到1mol氯酸钠,根据氯元素守恒最终得到0.5molCu(ClO4)2·6H2O,因此产率=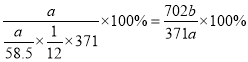 ,故答案为:(702b/371a)×100%;
,故答案为:(702b/371a)×100%;
(6)A方式Cu(ClO4)2![]() CuCl2+4O2↑中氧元素由-2价变为0价转移电子为4×2×2=16,氯由+7价变为-1价,转移电子为8×2=16,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式可能氯由+7价变为0价,转移电子为7×2=14,氧元素由-2价变为0价转移电子为3.5×2×2=14,综合可知生成物为氧气、氯气和氧化铜,故反应为2Cu(C1O4)2
CuCl2+4O2↑中氧元素由-2价变为0价转移电子为4×2×2=16,氯由+7价变为-1价,转移电子为8×2=16,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式可能氯由+7价变为0价,转移电子为7×2=14,氧元素由-2价变为0价转移电子为3.5×2×2=14,综合可知生成物为氧气、氯气和氧化铜,故反应为2Cu(C1O4)2![]() 2CuO+7O2↑+2C12↑,故答案为:2Cu(C1O4)2
2CuO+7O2↑+2C12↑,故答案为:2Cu(C1O4)2![]() 2CuO+7O2↑+2C12↑。
2CuO+7O2↑+2C12↑。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常状况下,A为固态单质。根据如图所示转化关系,回答:
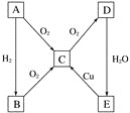
(1)写出A、C、E的化学式:
A.__________,C.__________,E.__________。
(2)写出下列反应的化学方程式:
①E→C___________________________________。
②C→D_________________________。
(3)B与E的浓溶液__________(填“能”或“不能”)发生反应,若能反应,则反应的化学方程式为___,反应现象为_________。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因:__,并写出有关的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)![]() CO(g)+H2(g);(乙)CO(g)+H2O(g)
CO(g)+H2(g);(乙)CO(g)+H2O(g)![]() CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A. ①②⑤B. ③④⑥C. ①⑥D. ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
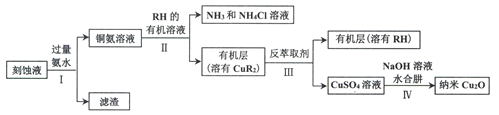
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为___。
(2)反应开始至2min,气体Z的平均反应速率为___。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ___(填”增大”“减小”或”相等”)。
③若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
(4)在一密闭容器中发生反应N2(g)+3H2(g) ![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
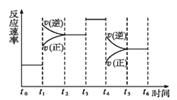
①处于平衡状态的时间段是___(填字母代号)。
A.t0t1 B.t1t2 C.t2t3 D.t3t4 E.t4t5 F.t5t6
②判断t1、t3、t4时刻分别改变的一个条件是:t1时刻___;t3时刻___;t4时刻___。 (填字母代号)
A. 增大压强 B.减小压强 C.升高温度 D. 降低温度 E.加催化剂 F.恒温恒容时充入氮气
③依据上述②中的结论,下列时间段中,氨的百分含量最高的是___(填字母代号)。
A.t0t1 B.t2t3 C.t3t4 D.t5t6。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用 BMED膜堆(如图所示).模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜( a . d)。已知:在直流电源的作用下.双极膜内中间界面层发生水的解离,生成 H+ 和 OH-。下列说法正确的是
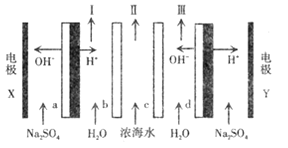
A.电极 Y连接电源的正极,发生还原反应
B.电解质溶液采用Na2SO4 溶液可避免有害气体的产生
C.I 口排出的是混合碱,II 口排出的是淡水
D.a左侧膜为阴离子交换膜 ,c 为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双安妥明可用于降低血糖中的胆固醇.其结构简式为: 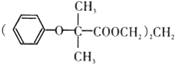
该物质的合成路线如图所示:
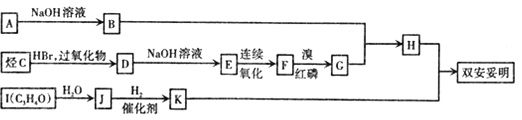
已知:I. 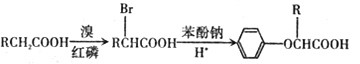
II.RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
III.C的密度是同温同压下氢气密度的28 倍.且支链有一个甲基;I 能发生银镜反应且1 molI能与 2molH2 发生加成反应;K 的结构具有对称性。
请回答下列问题:
(1)A的结构简式为 ___________,J中所含官能团名称为_________。
(2)D的名称为__________ 。
(3)反应D→E的化学方程式为 ___________,其反应类型是__________。
(4)“H+K→双安妥明”的化学方程式为 ___________。
(5)L为比H的相对分子质量小14的同系物.其中满足①苯环上有两个取代基,② 苯环上一氯代物只有两种,③能与FeCl3溶液发生显色反应.且属于酯的L有_______种 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醇是工业常见的有机原料,常用来制取纺织工业的乙二醛和化妆品行业的乙醛酸。
①乙二醇(HOCH2CH2OH)气相催化氧化法制取乙二醛(OHC-CHO),主要反应为:HOCH2CH2OH(g)+O2(g)![]() OHC—CHO(g)+2H2O(g) H
OHC—CHO(g)+2H2O(g) H
化学键 | O—H | C—H | C—O | C=O | O=O | C—C |
键能(kJ·mol-1) | 436 | 413 | 356 | 745 | 493 | 346 |
则H=_____kJ·mol-1。
②当原料气中氧醇比(氧气和乙二醇的物质的量之比)一定时,乙二醛和副产物CO2的产率与反应温度的关系如图所示,则反应中应控制的适宜温度是___(填字母)。
a.低于450℃
b.450℃~490℃
c.高于495℃
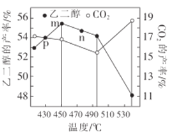
p、m、n三点中____是平衡点,__是逆反应速率最快的点。
③温度超过495℃时,乙二醛的产率直线下降的原因是___。
(2)将乙二醇氧化为乙二酸,再利用乙二酸(HOOCCOOH)通过电解制备乙醛酸,阴极的电极反应式为____。
(3)液相氧化制备乙醛酸是近年研究的热点。向25L某浓度的乙二醛溶液中,加入适量的催化剂V2O5/C,以0.1mol·L-1的流速通入氧气,测得溶液中乙二醛的浓度、溶液的pH随时间变化的关系如图所示:
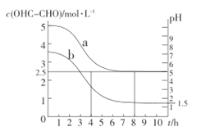
①图中曲线___(填“a”或“b”)表示溶液的pH值随时间变化的曲线。
②V2O5/C表示将催化剂覆盖在纳米碳纤维上,其目的是___。
③写出制备乙醛酸(HOC—COOH)的化学反应方程式:____,根据图中数据算出8h内乙醛酸的平均生成速率v(HOC—COOH)=____;该实验条件下乙醛酸的电离常数Ka=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com