
【题目】W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数都是1,Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍,且X与Z同主族。由此可知:
(1)写出元素符号:W为_________,Z为_________
(2)W2X是由_________键组成的分子,其电子式为_________
(3)写出Y的最高价氧化物对应水化物与Z的最高价氧化物对应水化物反应的离子方程式_________
【答案】H S (极性)共价键 ![]() H++OH-=H2O
H++OH-=H2O
【解析】
Y和W的最外层电子数都是1,且Y为金属元素,Y元素之前至少有两种主族元素,而Li元素之前只有H一种非稀有气体元素,所以Y为Na元素,则W为H元素;Z的原子序数比Y大,则Z也是第三周期元素,X为第二周期元素,X与Z同主族,设X的质子数为a,则Y的质子数为a+8,所以有11+a+8=3(a+1),解得a=8,所以X为O元素,Y为S元素。
(1)根据分析可知W为H,Z为S;
(2)W2X为H2O,是由氧原子和氢原子之间的极性共价键组成的分子,电子式为![]() ;
;
(3)Y为钠元素,Z为硫,对应的最高价氧化为对应的水化物分别为氢氧化钠和硫酸,二者发生中和反应,反应的离子方程式为H++OH-=H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。
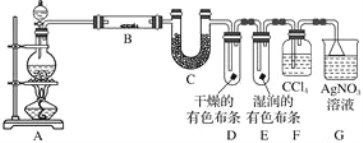
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是
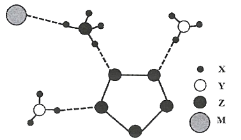
A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是

A. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Fe3++Cu=Fe2++Cu2+
B.AgNO3溶液与NaCl溶液的反应:Ag++Cl-=AgCl↓
C.Cu(OH)2与CH3COOH溶液的反应:OH-+H+=H2O
D.CaCO3与HNO3溶液的反应:![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,0.1 mol·L-1HA溶液中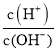 =108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
=108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
(1)HA的电离常数Ka为________,BOH是________(填“强电解质”或“弱电解质”)。
(2)pH相等的BOH溶液与BA溶液,分别加热到相同的温度后BOH溶液的pH________(填“>”“=”或“<”)BA溶液的pH。
(3)已知碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中滴加盐酸直至过量,则与H+作用的粒子依次为___________________。
(4)25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________。
②0.10 mol·L-1 NaHSO3溶液中离子浓度由大到小的顺序为_____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒被称为“工业味精”“工业维生素”,在发展现代工业、国防等方面发挥着至关重要的作用。某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒铬的工艺流程如下:
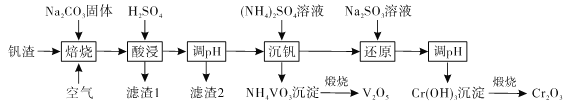
回答下列问题:
(1)“焙烧”时会生成NaVO3和Na2CrO4,生成Na2CrO4的化学方程式是_________。
(2)滤渣1中主要含_______。滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于_____。(常温下,当溶液中离子浓度小于1×10-6mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)
(3)“沉钒”所用0.1mol/L (NH4)2SO4溶液中,离子浓度由大到小的顺序是_______。
(4)“还原”时溶液的pH在2.5左右,此时控制酸度应选用_______(填标号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸 D.硫酸铵
(5)NH4VO3、Cr(OH)3煅烧时发生反应的类型是否相同?___________。
(6)工业上可用电解还原法处理含Cr2O72- 的酸性废水。用铁板作阳极,电解过程中,废水pH逐渐上升,Cr3+、Fe3+都以氢氧化物沉淀析出,达到废水净化的目的。
①其中阳极的电极反应式是___________。
②电解过程中,废水pH上升的原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。

(1)A中发生反应的化学反应方程式为________________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置D中能看到的实验现象分别是 ___________________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)B处发生反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料W的结构简式为![]() ,其单体A可由淀粉转化而来,并可发生如图所示一系列变化,关于各步变化的反应类型描述正确的是( )
,其单体A可由淀粉转化而来,并可发生如图所示一系列变化,关于各步变化的反应类型描述正确的是( )
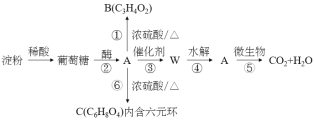
A.由淀粉转化为葡萄糖是取代反应
B.A→W是加聚反应
C.A→C是消去反应
D.A→B是酯化反应且生成的B能与溴水因反应而褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com