
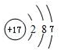
 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7. .
. .
.分析 A、B、C、D、E、F是原子序数由小到大排列的六种短周期主族元素,A是周期表中原子半径最小的元素,则A为H元素;A与D同主族,D为Na元素;其中A、B、C、E的原子序数之和为32,B、C左右相邻,C与E分别位于同族,设C的原子序数为x,则1+x-1+x+x+8=32,解得x=8,可知B为N,C为O,E为S,结合原子序数及短周期可知F只能为Cl,以此来解答.
解答 解:A、B、C、D、E、F是原子序数由小到大排列的六种短周期主族元素,A是周期表中原子半径最小的元素,则A为H元素;A与D同主族,D为Na元素;其中A、B、C、E的原子序数之和为32,B、C左右相邻,C与E分别位于同族,设C的原子序数为x,则1+x-1+x+x+8=32,解得x=8,可知B为N,C为O,E为S,F只能为Cl,(1)F元素原子结构示意图为 ,最高价为+7价,最高价氧化物的化学式为Cl2O7,故答案为:
,最高价为+7价,最高价氧化物的化学式为Cl2O7,故答案为: ;Cl2O7;
;Cl2O7;
(2)A与C按原子数目1:1组成的化合物为过氧化氢,其电子式为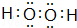 ,故答案为:
,故答案为: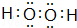 ;
;
(3)用电子式表示D和F组成化合物的形成过程为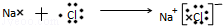 ,故答案为:
,故答案为: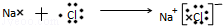 ;
;
(4)A、B、C、E四种元素中的三种能组成一种常见的强酸为HNO3或H2SO4.硝酸的稀溶液能与铜反应,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,其中起酸性作用的酸占消耗酸总物质的量的百分比是$\frac{6}{8}$×100%=75%,故答案为:75%;
(5)1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体,气体的物质的量为$\frac{44.8L}{22.4L/mol}$=2mol,可知X为硫酸铵,与NaOH反应生成气体为氨气,则加热条件下X与NaOH浓溶液反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子序数关系推断元素为解答的关键,侧重分析与应用能力的考查,注意(4)中硝酸与Cu发生氧化还原反应,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:实验题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
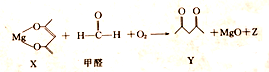
| A. | X 是还原剂 | B. | Y的分子式为C5H8O2 | ||
| C. | Z的摩尔质量为44g | D. | 除去1mol甲醛时,转移2mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下使氢成为二次能源 | |
| B. | 寻找优质催化剂,使CO2与H2O反应生成CH4和O2,并放出热量 | |
| C. | 寻找优质催化剂,利用太阳能使大气中的CO2和海底开采的CH4合成合成气(CO、H2) | |
| D. | 将固态碳合成C60,以C60作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验过程中水的电离程度的变化是先增大后减小 | |
| B. | 当溶液呈中性时,反应恰好完全 | |
| C. | 当反应恰好完全时,消耗NaOH溶液10mL | |
| D. | 当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{22.4}$摩/升 | B. | $\frac{ab}{22400}$摩/升 | ||
| C. | $\frac{ab}{22400+36.5a}$摩/升 | D. | $\frac{1000ab}{22400+36.5a}$摩/升 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com