
用碳酸钙与1mol/L稀盐酸反应制取二氧化碳,下列措施对化学反应速率几乎没有影响的是( )
|
| A. | 改用浓度为0.5mol/L的稀硫酸 |
|
| B. | 加入更多的碳酸钙 |
|
| C. | 稍微加热,升高反应温度 |
|
| D. | 加入少量醋酸钠晶体 |
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
影响化学反应速率的因素有温度、浓度、压强、催化剂、固体物质的表面积等.
浓度:增加反应物浓度,使反应速率加快;
温度:升高温度,使反应速率加快;
压强:对于有气体参与的化学反应,除体积其它条件不变时,增大压强,使反应速率加快;
使用正催化剂,使反应物速率加快;
增大固体表面积能使反应速率加快.
解答:
解:A.纯净的碳酸钙与硫酸反应生成硫酸钙会覆盖在大理石的表面,阻碍了反应的进行,反应速率减慢,故A错误;
B、加反应中,固体量的增减不会引起速率的变化,所以加入更多的碳酸钙,反应速率几乎不变,故B正确;
C、升高温度,使反应速率加快,所以用相同浓度、温度较高的盐酸代替常温下的盐酸反应速率加快,故C错误;
D、加入醋酸钠会和盐酸之间反应生成氯化钠和醋酸,从盐酸到醋酸,会使反应速率减慢,故D错误;
故选B.
点评:
本题考查影响反应速率的因素,掌握影响化学反应速率的因素有哪些,抓住影响的本质,是解题的关键,平时学习需理解记忆.


科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105 Pa, 32 g O2和O3的混合气体所含原子数为2NA
C.标准状况下,11.2LH2O 含有的分子数为0.5NA
D.在常温常压下,44gCO2含有的分子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属及金属键的说法正确的是( )
|
| A. | 金属键具有方向性和饱和性 |
|
| B. | 金属键是金属阳离子与自由电子间的相互作用 |
|
| C. | 金属导电是因为在外加电场作用下产生自由电子 |
|
| D. | 金属具有光泽是因为金属阳离子吸收并放出可见光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列物质,用编号填空回答下列问题:
A.干冰 B.金刚石 C.氦 D.过氧化钠 E.二氧化硅 F.溴化铵
(1)通过非极性键形成的原子晶体是: .
(2)可由原子直接构成的晶体是: .
(3)含有离子键、共价键、配位键的化合物是: .
(4)含有非极性键的离子化合物是: .
(5)已知微粒间的作用力包括离子键、共价键、金属键、范德华力、氢键.氯化钠熔化,粒子间克服的作用力为 ;二氧化硅熔化,粒子间克服的作用力为 ;干冰气化,粒子间克服的作用力为 .A、B、C、D四种物质的熔点从低到高的顺序为 (填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学的说法正确的是( )
|
| A. | 需要加热才能发生的反应是吸热反应 |
|
| B. | 等量的金刚石和石墨固体分别完全燃烧,前者放出热量多,说明金刚石更稳定 |
|
| C. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
|
| D. | 由热化学方程式 3H2(g)+N2(g)⇌2NH3(g)△H=﹣92 kJ/mol可知,1molN2与3molH2放入密闭容器中,在催化剂的作用下反应得到氨气,将释放92kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
mA(s)+nB(g)⇌qC(g),的可逆反应,在1×105pa与2×105pa两种压力条件下,B的体积分数与温度的关系如右图所示,有关叙述正确的是( )
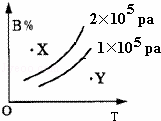
|
| A. | △H>0 | B. | X点,v正>v逆;Y点,v正<v逆 |
|
| C. | m+n>q | D. | X点比Y点反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
、TiO2可通过下述两种方法制备金属钛:
方法一:电解TiO2来获得Ti,将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用石墨作电解槽池.
(1)阳极的电极反应式为 .
(2)电解过程中需定期更换石墨电极的原因是 .
方法二:先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(3)TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1该反应难以发生,原因是 .
不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4,当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1
TiO2(s)+C(s)+2Cl2(g)=TiCl4(l)+CO2(g)△H=
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;②向上述稀硫酸中插入铜片,没有看到有气泡生成;③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转.下列关于以上实验设计及现象的分析,不正确的是( )
|
| A. | 实验①、②说明锌能与稀硫酸反应而铜不能 |
|
| B. | 实验③说明发生原电池反应时会加快化学反应速率 |
|
| C. | 实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
|
| D. | 实验④说明该原电池中铜为正极、锌为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com