
����Ŀ����25 ��ʱ����a g NH3��ȫ����ˮ���õ�V mL pH��8�İ�ˮ������ð�ˮ���ܶ�Ϊ�� g��cm��3�����ʵ���������Ϊ�������к�NH4+�����ʵ���Ϊb mol�������������������ǣ� ��
A�����ʵ���������Ϊ����![]() ��100%
��100%
B�����ʵ����ʵ���Ũ��c��![]() mol��L��1
mol��L��1
C����Һ��c(OH��)��![]() mol��L��1
mol��L��1
D��������Һ���ټ���VmLˮ��������Һ����������С��0.5��
���𰸡�C
��������
���������A����ˮ��Һ����Ϊ����������Һ���ܶ�Ϊ�� gcm-3�����ΪVmL��������Һ����Ϊ��Vg�����ʰ���������Ϊag�����ʵ���������Ϊ![]() ����A��ȷ;
����A��ȷ;
B��a g NH3�����ʵ���Ϊ![]() ����Һ���ΪVmL��������Һ�����ʵ���Ũ��Ϊ
����Һ���ΪVmL��������Һ�����ʵ���Ũ��Ϊ mol/L����B��ȷ;
mol/L����B��ȷ;
C����ˮ��Ũ��Ϊ![]() mol/L��һˮ�ϰ���������ʣ�������ȫ���룬������Һ����Һ��c(OH-)��
mol/L��һˮ�ϰ���������ʣ�������ȫ���룬������Һ����Һ��c(OH-)��![]() mol/L����C����;
mol/L����C����;
D��ˮ���ܶȱȰ�ˮ���ܶȴ��������İ�ˮ��ˮ��ˮ�������������Ϻ���Һ����������ԭ��ˮ��2������Һ�а�����������ͬ����������������Һ���ʵ���������С��0.5w����D������


 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȷ���Ҷ��������Ƿ��м��Ե�ʵ����
A���ⶨ�е� B���⾲���Һ��Ӱ��
C���ⶨ�����ܶ� D�����״��������Ħ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ܱ������У��ֱ����������ͬ�ļס����������壬�����������¶Ⱥ�ѹǿ����ͬ���Ҽ��ܶȴ����ҵ��ܶȣ�������˵����ȷ����
A���ķ��������ҵķ�������
B�������ʵ������ҵ����ʵ���С
C������������ף���
D������Է����������ҵ���Է�������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ��Ba(OH)2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯��������ͼ��ʾ�����з�����ȷ������ ��
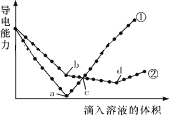
A���������μ�H2SO4��Һ�ı仯����
B��b����Һ�д������ڵ�������SO42-��Na����OH��
C��a��d�����Ӧ����Һ��������
D��c������Һ�к�����ͬ����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����������ʹ��ˮ�е�H+������Ŀ���ӵ���
A. S2�� B. CO32�� C. NH4+ D. Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�����͵����ǽ������ϣ����㷺Ӧ���ڼ��ɵ�·�����������Ʊ���Ӧԭ��Ϊ��Al2O3+N2+3C�T2AlN+3CO���Ʊ������У�ԭ����Ȳ�����Ӧ����ȫ�����ض�����ɲ�Ʒ�к���̼��Al2O3�����ʣ�Ϊ�ⶨ��Ʒ��AlN������������ijͬѧ����ͼ1װ�ý������ʵ�飮��ѡ�õĻ�ѧ�Լ�Ϊ��mg������Ƭ״���塢NaOH������Һ��ˮ��ú�͡�ҽ�þƾ����ش��������⣺

��1����װ��ʵ��װ�ã�ʹ��ǰ��һ��Ӧ��
��2��ͼ1��B�����Լ����ѡ�� ������ţ���
��ú�� ��ҽ�þƾ� ��ˮ
��֪A ����NaAlO2���ɣ����ų��д̼�����ζ���壬д��A�з�����Ӧ����������ʽ ��
��3����ȡC����Ͳ����Һ�����ʱ��Ӧע���������⣬������� ������ţ�
a��C��Һ�治������ʱ��������
b�������ƶ�C��ʹ֮Һ����B��Һ����ƽ
c��A�в����������ݳ�
d�������밼Һ����ʹ���ƽ
��4��mg������������NaOH������Һ��Ӧ��ʵ�������C���ռ���Һ������ΪVL��������ɱ�״��������AlN��Ʒ�Ĵ���Ϊ ��д�������ʽ����
��5������ʵ�鷽��������������������������������ϴ����˽����������A��B����װ���е�һ�֣���ͨ����ڽ��У���ֻ����м��ֱ�Ҫ�����ݲ�д�����������ͿɱȽ�ȷȷ����Ʒ��AlN��������������������װ���ǣ� ������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���3�������Ϊ1.0L�ĺ����ܱ������У���Ӧ2H2(g)+CO(g) ![]() CH3OH(g)�ﵽƽ�⡣����˵������ȷ����( )
CH3OH(g)�ﵽƽ�⡣����˵������ȷ����( )
���� | �¶�/�� | ���ʵ���ʼŨ��/molL-1 | ���ʵ�ƽ��Ũ��/molL-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
�� | 400 | 0.20 | 0.10 | 0 | 0.080 |
�� | 400 | 0.40 | 0.20 | 0 | |
�� | 500 | 0 | 0 | 0.10 | 0.025 |
A���÷�Ӧ������Ӧ����
B���ﵽƽ��ʱ���������з�Ӧ��ת���ʱ��������е�С
C���ﵽƽ��ʱ����������c(H2)������������c(H2)������
D���ﵽƽ��ʱ���������еķ�Ӧ���ʱ��������еĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�ҵ�ϣ��ϳɰ����Ʊ�����һ��������������������£�

��1���ϳ����з�����ӦN2(g)+3H2(g)![]() 2NH3(g)��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1___________300��(����>������<������=��)��
2NH3(g)��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1___________300��(����>������<������=��)��
![]()
��2�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����ѧ�����ô�ԭ������Ƴɰ���������ȼ�ϵ�أ��������ҺΪKOH�����缫������Ӧ�ĵ缫��ӦʽΪ___________________��
��3����80��ʱ����ͭ��Ũ���ᷴӦ�õ���0.40mol N2O4�������2L�Ѿ���յĹ̶����ܱ������з�����ӦN2O4 (g)![]() 2NO2(g)����H>0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2(g)����H>0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�

������a=_________�����¶�ʱ�÷�Ӧ��ƽ�ⳣ��K=____________��
���ı�����ʹ��Ӧ���´ﵽƽ�⣬��ʹc(NO2)/c(N2O4)ֵ��С�Ĵ�ʩ��___________(�����)��
A������N2O4����ʼŨ�� B�������¶� C��ʹ�ø�Ч���� D������������ͨ��ϡ������
��4�����᳧��β��ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ��齫���������ﻹԭΪ������ˮ����Ӧ����Ϊ��CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ��H=��574kJmol��1
4NO(g)+CO2(g)+2H2O(g) ��H=��574kJmol��1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ��H=��1160kJmol��1
2N2(g)+CO2(g)+2H2O(g) ��H=��1160kJmol��1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��____________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������( )

A��ͼ1��ʾͬ�¶��£�pH = 1������ʹ�����Һ�ֱ��ˮϡ��ʱpH�ı仯���ߣ���������II Ϊ���ᣮ��b����Һ�ĵ����Ա�a��ǿ
B��ͼ2��ʾ0.1000 mol/L CH3COOH��Һ�ζ�20.00mL0.1000mol/LNaOH��Һ���õ��ĵζ�����
C��ͼ3��ʾѹǿ�Կ��淴Ӧ2A(g)+2B(g)![]() 3C(g)+D(s)��Ӱ��,�ҵ�ѹǿ�ȼ�ѹǿ��
3C(g)+D(s)��Ӱ��,�ҵ�ѹǿ�ȼ�ѹǿ��
D����ͼ4������ȥCuSO4��Һ�е�Fe3+������Һ�м�������CuO��pH ��4����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com