
| A. | 在12.0g NaHSO4晶体中,所含离子数目为0.3NA | |
| B. | 在1.0L 1.0mol/L的NaA1O2溶液中,含有的氧原子数为2NA | |
| C. | 将1molCl2通入足量水中,转移电子数为NA | |
| D. | 常温常压下,2.2gC O2和N2O的混合气体含有的电子数为1.1NA |
分析 A.熔融的NaHSO4中含有的阳离子只有钠离子,阴离子为硫酸氢根离子;
B.偏铝酸钠溶液中偏铝酸钠和水都含有氧原子;
C.氯气与水反应为可逆反应,消耗1mol氯气转移1mol电子;
D.二氧化碳与一氧化二氮的摩尔质量相同,且1个分子都含有22个电子.
解答 解:A.12.0g熔融的NaHSO4的物质的量为0.1mol,0.1mol熔融硫酸氢钠电离出0.1mol钠离子和0.1mol硫酸氢根离子,所以含有的离子数为0.2NA,故A错误;
B.偏铝酸钠溶液中偏铝酸钠和水都含有氧原子,所以在1.0L 1.0mol/L的NaA1O2溶液中,含有的氧原子数远远大于2NA,故B错误;
C.氯气与水反应为可逆反应,可逆反应不能进行到底,所以将1molCl2通入足量水中,氯气不能完全反应,转移电子数小于NA,故C错误;
D.常温常压下,2.2gCO2和N2O的混合气体含有的电子数为$\frac{2.2g}{44g/mol}$×22×NA=1.1NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意硫酸氢钠的结构组成,注意可逆反应特点.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| W | 周期表中原子半径最小的元素 |
| X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | M层比K层少1个电子 |
| T | 存在两种同素异形体,其中一种可吸收紫外线 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:苯酚(
已知:苯酚(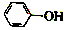 )在水中的电离方程式为
)在水中的电离方程式为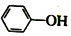 ?
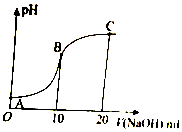
?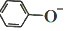 +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )| A. | A点溶液中,苯酚的电离度约为0.01% | |
| B. | B点溶液的pH<7 | |
| C. | C点溶液中存在c(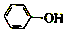 )>c(OH-)>c(H+) )>c(OH-)>c(H+) | |
| D. | A 点溶液加少量水稀释,溶液中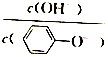 减小 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O的中子数为8 | B. | 16O和18O质子数相差2 | ||
| C. | 16O与18O核电荷数相等 | D. | 1个16O与1个18O质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 向醋酸溶液中加水,醋酸的电离程度增大,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$增大 | |
| C. | 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若NaHA溶液中的pH>7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液去油污:CO32-+H2O═HCO3-+OH- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7gNH4C1中含有的共用电子对数为NA | |
| B. | 0.5mol•L-1CH3COONa溶液中含有CH3COO-的数目少于0.5 NA | |
| C. | 22gN2O和22gCO2所含有的质子数均为11NA | |
| D. | 足量的镁与一定量的浓硫酸充分反应,放出2.24LSO2和H2混合气体时,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
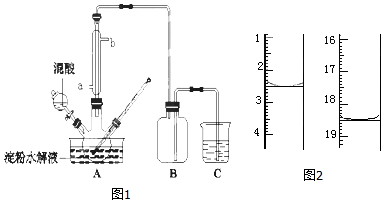
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com