
| 元素 | 铍 | 硼 | 镁 | 铝 | 硅 | 镓 |
| 电负性 | 1.6 | 2.0 | 1.2 | x | 1.8 | 1.8 |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
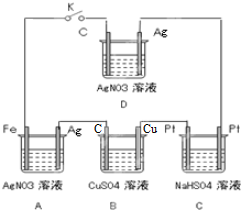
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图:
现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图:查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | 5 | 8 | |
| N2的浓度(mol?L) | c1 | 1.5 | |
| NH的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g?L) | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com