���𰸡�
��������1��������Һˮ���Լ��ԣ�������Ҫ�ɷ�Ϊ��֬������������ڼ�����Һ��ˮ������������ˮ�����ʣ�
��2����ĭ�������̼�����ƺ���������Һ��ˮ����ٽ��������������Ͷ�����̼���壻
��3�����ݷ�Ӧ�������������Ϊ����������Ȼ������壻SOCl
2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã�
��4�������ݵ���ܷ�Ӧ���ŵ���ԭ��أ�Ǧ������ʧ���ӷ���������Ӧ��
�ڳ��ʱԭ��������ӵ�Դ�����������ص�����ʧ���ӷ���������Ӧ��
�����ݵ���ܷ�Ӧ���Ԫ�ػ��ϼ۱仯�������ת�ƽ�ϻ�ѧ����ʽ�������ĵ����
��5��������Һ�������غ�����жϣ�
����⣺��1��������Һˮ���Լ��ԣ�������Ҫ�ɷ�Ϊ��֬������������ڼ�����Һ��ˮ������������ˮ�����ʣ��Լ��Ե����ӷ���ʽΪ��CO
32-+H
2O?HCO
3-+OH
-��HCO
3-+H
2O?H
2CO
3+OH
-
�ʴ�Ϊ��CO
32-+H
2O?HCO
3-+OH
-��HCO
3-+H
2O?H
2CO
3+OH
-��
��2����ĭ�������̼�����ƺ���������Һ��ˮ����ٽ��������������Ͷ�����̼���壻��Ӧ�����ӷ���ʽΪ��3HCO
3-+Al
3+=Al��OH��
3��+3CO
2����
�ʴ�Ϊ��3HCO
3-+Al
3+=Al��OH��
3��+3CO
2��
��3�����ݷ�Ӧ�������������Ϊ����������Ȼ������壻SOCl
2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã���Ӧ�Ļ�ѧ����ʽΪ��SOCl
2+H
2O=2HCl��+SO
2��������AlCl
3��Һ���ܵõ���ˮAlCl
3��ʹSOCl
2��AlCl
3?6H
20��ϲ����ȣ��ɵõ���ˮAlCl
3��SOCl
2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã�
�ʴ�Ϊ��SOCl
2+H
2O=2HCl��+SO
2������Ӧ�������Ȼ�����������������ӵ�ˮ�⣻
��4�������ݵ���ܷ�Ӧ���ŵ���ԭ��أ�Ǧ������ʧ���ӷ���������Ӧ���缫��ӦΪ��Pb+SO
42--2e
-=PbSO
4���ʴ�Ϊ��Pb+SO
42--2e
-=PbSO
4��
�ڳ��ʱԭ��������ӵ�Դ�����������ص�������ʧ���ӷ���������Ӧ���缫��ӦΪ��PbSO
4+2H
2O-2e
-=4H
++SO
42-+PbO
2���ʴ�Ϊ��PbSO
4+2H
2O-2e
-=4H
++SO
42-+PbO
2��
��Ǧ�����ܵĻ�ѧ����ʽΪ��Pb+PbO
2+2H
2SO
4 
2PbSO
4+2H
2O�����ݷ�Ӧ��֪����ת��2mol����������2mmol���ʴ�Ϊ��2��
��5��0.1mol/L HA��Һ��0.1mol/L NaOH��Һ������������NaA��Һ����û����Һ��pH=8��c��H+��=10-8mol/L����Һ�Լ��ԣ�˵��A
-����ˮ�⣬��Һ�д��������غ㣺c��OH
-��=c��H
+��+c��HA������c��OH
-��-c��HA��=c��H
+��=10
-8mol/L��
�ʴ�Ϊ��10
-8��
���������⿼��������ˮ��ķ���Ӧ�ã�ԭ��ص���ԭ���ķ����жϣ��������Һ�е������غ����Ӧ�ã���Ŀ�Ѷ��еȣ�

 2PbSO4+2H2O
2PbSO4+2H2O 2PbSO4+2H2O�����ݷ�Ӧ��֪����ת��2mol����������2mmol���ʴ�Ϊ��2��
2PbSO4+2H2O�����ݷ�Ӧ��֪����ת��2mol����������2mmol���ʴ�Ϊ��2��


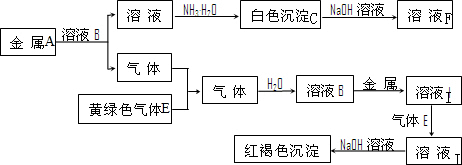
 A��B��C��D�����ɶ�����Ԫ����ɵij������ʣ�����A��B��C����ͬһ��Ԫ�أ���һ���������ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����
A��B��C��D�����ɶ�����Ԫ����ɵij������ʣ�����A��B��C����ͬһ��Ԫ�أ���һ���������ת����ϵ��ͼ��ʾ�����ֲ�������ȥ���� H++CN-��H2O
H++CN-��H2O H++OH-��CN-+H2O
H++OH-��CN-+H2O HCN+OH-
HCN+OH- H++CN-��H2O
H++CN-��H2O H++OH-��CN-+H2O
H++OH-��CN-+H2O HCN+OH-
HCN+OH-