
分析 (1)氯气和氢氧化钠溶液反应生成氯化钠,氯酸钠和水,结合原子守恒和氧化还原反应电子守恒配平书写化学方程式;
(2)利用物质溶解度的不同析出晶体;
(3)氯化钠溶解度随温度变化不大,氯酸钾溶解度随温度变化大,可以通过蒸发浓缩,冷却结晶的方法得到溶质晶体;
(4)标注元素化合价变化,元素化合价升高的做还原剂被氧化,元素化合价降低的做氧化剂被还原,结合电子转移总数和氧化还原反应定量关系计算得到.
解答 解:(1)氯气和氢氧化钠溶液反应生成氯化钠,氯酸钠和水,结合原子守恒和氧化还原反应电子守恒配平书写化学方程式为:3Cl2+6NaOH=5NaCl+NaClO3+3H2O,
故答案为:3Cl2+6NaOH=5NaCl+NaClO3+3H2O;
(2)利用物质溶解度的不同析出晶体,NaClO3溶液与KC1能发生复分解反应的原因是KCl03溶解度较小,
故选:C;
(3)氯化钠溶解度随温度变化不大,氯酸钾溶解度随温度变化大,可以通过蒸发浓缩,冷却结晶、过滤洗涤,干燥的方法得到溶质晶体,
故答案为:蒸发浓缩;冷却结晶;
(4)标注元素化合价变化,元素化合价升高的做还原剂被氧化,元素化合价降低的做氧化剂被还原,8KClO3+24HCl=8KCl+9Cl2↑+6ClO2↑+12H2O,反应中氯元素化合价+5价变化为+4价和0价,-1价氯元素变化为0价,电子转移总数为16e-,还原产物为Cl2、ClO2,氧化产物为Cl2,结合电子转移总数和氧化还原反应定量关系计算得到,8molKClO3被还原电子转移16mol,如有lmol KClO3被还原,转移的电子数目为2NA,如有1mol HC1被氧化,转移的电子数目为NA,
故答案为:Cl2、ClO2;2NA;NA.
点评 本题考查了氧化还原反应电子转移总数计算,产物分析判断物质分离方法的应用,掌握基础是关键,题目难度中等.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式:次氯酸: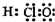 ;过氧化钠: ;过氧化钠: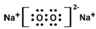 ;羟基: ;羟基: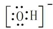 | |
| B. | KHSO4熔融电离:KHSO4=K++H++SO42-;KHCO3溶解于水:KHCO3=K++H++CO32- | |
| C. | 高聚物化学式:聚异戊二烯: ;PVC: ;PVC: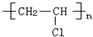 ;PE: ;PE: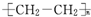 | |
| D. | 下列分子式代表的有机物均有可能与NaHCO3反应放出CO2:C5H12O2、C2H4O2、C7H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 25℃时,用pH试纸测定出某醋酸溶液的pH=3.50 | |
| D. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
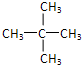
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 同价态的阳离子,甲比乙的氧化性弱 | |
| C. | 甲不能跟稀盐酸反应放出氢气而乙能 | |
| D. | 将甲、乙作电极组成原电池时,甲是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 | I7 | |
| A的电离能 | 1402 | 2856 | 4578 | 7475 | 9445 | 53267 | … | |
| B的电离能 | 1012 | 1907 | 2914 | 4964 | 6274 | 21267 | 25431 | |
| 序号 | I8 | I9 | I10 | I11 | I12 | I13 | I14 | … |
| B的电离能 | 29872 | 35905 | 40950 | 46261 | 54110 | 59024 | 271791 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com