
分析 (1)氯元素的最高价氧化物为Cl2O7,与水反应生成HClO4,所以当0.25mol该物质与一定量的水混合得到一种稀溶液,放出QkJ的热量,该为HClO4溶液,1molCl2O7反应放出热量为4QkJ,结合热化学方程式书写原则书写;
(2)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断;
(3)根据化学键断裂要吸收热量,形成化学键要放出热量,1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ;
(4)根据生成1mol水放出的热量计算反应热,生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,结合热化学方程式书写方法写出.
解答 解:(1)氯元素的最高价氧化物为Cl2O7,与水反应生成HClO4,反应的化学方程式为Cl2O7+H2O=2HClO4,0.25mol时放出的热量为QkJ,则1mol反应放出4QKJ的热量,反应的热化学方程式为Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol,
故答案为:Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol.
(2)①Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由盖斯定律②×$\frac{3}{2}$-①得:2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=(-393.5kJ/mol)×$\frac{3}{2}$-234.1kJ/mol
即2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-824.4kJ/mol,
故答案为:-824.4;
(3)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,则1molN4气体转变为N2的热化学方程式:
N4 (g)=2N2(g)△H=-882KJ/mol,
故答案为:N4 (g)=2N2(g)△H=-882KJ/mol;
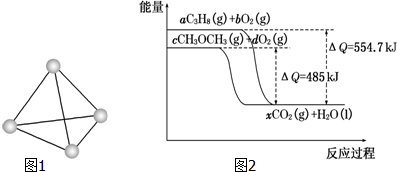
(4)由图象可知生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,
所以热化学方程式为CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455kJ•mol-1,
故答案为:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455kJ•mol-1.
点评 本题考查了热化学方程式书写方法,反应焓变的计算应用,图象分析判断,题目难度中等,注意基础知识的掌握与理解,盖斯定律应用需明确已知反应与目标热化学方程式的关系,为易错点.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 将MgCl2溶液小心蒸干得到无水MgCl2 | |
| B. | 通过蒸馏分离苯和1,2-二溴乙烷 | |
| C. | 电解AlCl3溶液可以得到金属铝 | |
| D. | 通过过滤从碘水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含一个双键的链状化合物 | B. | 含一个双键的环状化合物 | ||
| C. | 含一个三键的链状化合物 | D. | 含两个双键的链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
查看答案和解析>>
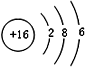
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com