
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸,标准液的浓度减小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故A错误;
B.锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故B错误;
C.滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故C错误;
D.读数时,视线与滴定管内液体的凹液面最低处保持一致,操作正确,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)不变,故D正确;
故选D.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O | |
| B. | 充电时每转移2 mol电子,阴极有1 mol Cd(OH)2被氧化 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 | |
| ① | ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ② | 3818Ar | 18 | 20 | 18 | 38 |
| ③ | 3216S2- | 16 | 16 | 18 | 32 |
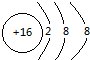 Mg2+
Mg2+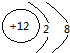 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | m+n<p | ||
| C. | 气体A的转化率升高 | D. | C气体的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
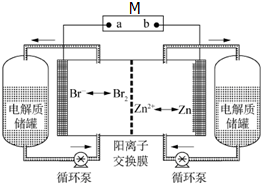 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )| A. | 锌溴液流电池总反应为:Zn+Br2═ZnBr2 | |
| B. | 放电时右侧电池电极发生氧化反应,电流从a极经用电器流向b极 | |
| C. | 放电时Zn2+从右侧经阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大 | |
| D. | 充电时左侧溴离子浓度下降,左侧电池电极连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa与O2反应得到32g固体产物,钠失去电子数为NA | |
| B. | 用1mL0.1mol•L-1FeCl3溶液制得的氢氧化铁胶体所含胶粒数为10-4NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,22.4LCH4中含有的碳原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com