
【题目】(1)有机物 CH3CH2COOCH3命名为_________________。
(2)写出丙烯发生加聚反应的方程式___________________________。
(3)C5H10属于烯烃的同分异构体有_________种,其氢气加成产物的一氯代物有3种的烯烃结构简式为________ (任意写其中一种即可)。
(4)等体积混合的两种气态烃共0.lmol,经充分燃烧后生成标况下CO23.36升和一定量的水,则其组合可能是____________。
A.CH4和C2H6 B.CH4和C2H4 C.CH4和C3H8 D.CH4和C3H6
(5)在![]() 溶液中通入足量的CO2的化学方程式为:_____________________。
溶液中通入足量的CO2的化学方程式为:_____________________。
【答案】 丙酸甲酯 ![]() 5 CH2=CHCH2CH2CH3 或 CH3CH=CHCH2CH3 A、B
5 CH2=CHCH2CH2CH3 或 CH3CH=CHCH2CH3 A、B 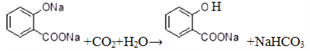
【解析】(1). 有机物 CH3CH2COOCH3可以视为由丙酸和甲醇通过酯化反应制得,故该物质的名称为:丙酸甲酯;
(2).丙烯结构中含有碳碳双键,在一定条件下发生加聚反应生成聚丙烯,故反应方程式为:![]()
(3). 戊烷的同分异构体有CH3CH2CH2CH2CH3、![]() 、
、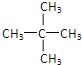 。
。
若为CH3CH2CH2CH2CH3,相应烯烃有CH2═CHCH2CH2CH3、CH3CH═CHCH2CH3,即有2种异构;若为![]() ,相应烯烃有:CH2═C(CH3)CH2CH3、CH3C(CH3)═CHCH3、CH3CH(CH3)CH═CH2,即有3种异构。
,相应烯烃有:CH2═C(CH3)CH2CH3、CH3C(CH3)═CHCH3、CH3CH(CH3)CH═CH2,即有3种异构。
若为 ,没有相应烯烃。
,没有相应烯烃。
所以分子式为C5H10的烯烃共有2+3=5种,其氢气加成产物的一氯代物有3种的烯烃结构简式为CH2=CHCH2CH2CH3、CH3CH=CHCH2CH3,故答案为:5;CH2=CHCH2CH2CH3 或 CH3CH=CHCH2CH3;
(4). 等体积混合的两种气态烃共0.1mol,经充分燃烧后生成标况下CO23.36 L和一定量的水,二氧化碳物质的量=3.36L÷22.4L/mol=0.15mol,则1mol混合烃含碳原子平均为1.5mol,只有A、B中碳原子等体积混合平均值为1.5,故其组合可能是A、B,
故答案为:A、 B.;
(5). 根据酸性:羧酸>碳酸>酚,则在![]() 溶液中通入足量的CO2的化学方程式为:
溶液中通入足量的CO2的化学方程式为: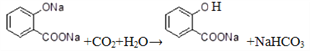 。
。


科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率: v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 0~6 min的平均反应速率: v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应至6 min时,c(H2O2)=0.30 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。
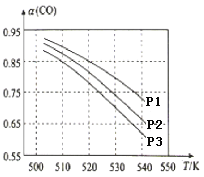
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2g KOH的稀溶液与1L 0.1molL﹣1的H2SO4溶液反应,放出11.46kJ的热量,下列热化学方程式正确的是( )
A.KOH(aq)+ ![]() ?H2SO4(aq)═
?H2SO4(aq)═ ![]() ?K2SO4(aq)+H2O(l)△H=﹣11.46 kJ?mol﹣1
?K2SO4(aq)+H2O(l)△H=﹣11.46 kJ?mol﹣1
B.2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=﹣11.46 kJ?mol﹣1
C.2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=+114.6 kJ?mol﹣1
D.KOH(aq)+ ![]() ?H2SO4(aq)═
?H2SO4(aq)═ ![]() ?K2SO4(aq)+H2O(l)△H=﹣57.3 kJ?mol﹣1
?K2SO4(aq)+H2O(l)△H=﹣57.3 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、NH4+、Cl﹣、CO32﹣和SO42﹣ . 现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.672L(标准状况下),但整个过程中无沉淀生成.
③第三份加入足量BaCl2溶液后得干燥沉淀6.63g,沉淀经足量盐酸洗涤,干燥后剩余4.66g.
请回答:
(1)c(CO32﹣)=mol/L.
(2)K+是否存在?(填“存在”或“不存在”);若存在,浓度范围是(若不存在,则不必回答第2问).
(3)根据以上实验,不能判断哪种离子是否存在? , 若存在,这种离子如何进行检验? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:
3X(气)+Y(气)═nZ(气)+2W(气) 5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.02mol/(Lmin)求:
(1)反应中Z气体的计量数n:;
(2)反应在5min末时,Y的转化率:;
(3)前5min以X浓度变化来表示的反应平均速率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com