
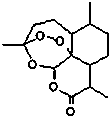
 东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )
东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
分析 A.根据结构简式确定分子式;
B.该分子中含有醚键、过氧键和酯基,酯基能发生水解反应;
C.用乙醚为溶剂在低温下从黄花蒿中提取青蒿素是利用了萃取;
D.过氧键具有强氧化性.
解答 解:A.根据结构简式确定分子式为C15H22O5,故A正确;
B.该分子中含有醚键、过氧键和酯基,酯基能发生水解反应,所以该物质能发生水解反应,故B正确;
C.用乙醚为溶剂在低温下从黄花蒿中提取青蒿素是利用其在有机物的溶解性较大,所以是利用了萃取原理,故C正确;
D.过氧键具有强氧化性,能使蛋白质变性而治疗疟疾,与酯基无关,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酯、过氧键等官能团,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2和CO都是酸性氧化物,都能与水反应 | |
| B. | Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 | |
| C. | Al2O3和Na2O按物质的量比1:1投入水中可得到澄清溶液 | |
| D. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
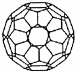
| A. | C60就是金刚石 | B. | C60属于有机化合物 | ||
| C. | C60的摩尔质量是720g/mol | D. | 1mol C60完全燃烧生成22.4L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
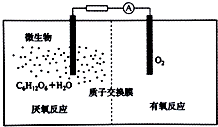 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
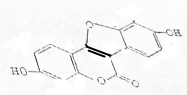
| A. | 该物质的分子式为C15H10O5 | |
| B. | 该物质中所有原子一定在同一平面内 | |
| C. | 1mol该物质最多可与5molBr2发生反应 | |
| D. | 1mol该物质最多可与3molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有6个电子 | B. | 位于元素周期表的第七周期 | ||
| C. | 主要化合价为-4价、+4价 | D. | “类铅”不能和盐酸反应放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
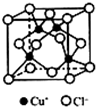 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com