
【题目】将22.4 g铁粉逐渐加入含HNO3 0.8 mol的硝酸溶液中,反应生成的气体的物质的量(x)(假设HNO3的还原产物只有NO)随消耗铁粉的物质的量(y)变化关系中正确的是
A. 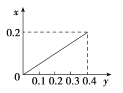 B.
B. 
C.  D.
D. 
【答案】C
【解析】
22.4g铁粉的物质的量为n(Fe)=22.4g÷56g/mol=0.4mol,假设铁完全反应需硝酸的物质的量为n,则:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+H2O
1 4
0.4mol n
1:4=0.4mol:n,解得n=1.6mol,由于1.6mol>0.8mol,所以Fe有剩余,根据硝酸计算生成NO的物质的量,参加反应生成NO的Fe的物质的量,则:
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+H2O
1mol 4 mol 1mol
0.2mol 0.8mol 0.2mol
最多产生NO的物质的量是0.2mol,此时反应产生Fe(NO3)3物质的量是0.2mol,后发生反应2Fe(NO3)3+Fe=3Fe(NO3)2,由于Fe(NO3)3物质的量是0.2mol,所以反应又消耗Fe粉0.1mol,此后就不再发生反应,用图像表示为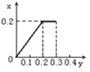 ,选项C正确。
,选项C正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。

请回答该实验中的问题。
(1)写出该反应的反应方程式:________________________________________,并指明该氧化还原反应的还原剂是_____________,氧化剂是____________。
(2)实验前必须对整套装置进行气密性检查,操作方法是______________________。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是________________________,烧瓶底部放置了几片碎瓷片,碎瓷片的作是__________________________________。
(4)酒精灯和酒精喷灯点燃的顺序是________________________________________。
(5)干燥管中盛装是的物质是___________________,作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是( )
2NO+O2在密闭容器反应,达到平衡状态的标志是( )
(1)单位时间内生成n molO2的同时,生成2n molNO2
(2)单位时间内生成n molO2的同时,生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. (1)(4)(5) B. (2)(3)(5) C. (2)(3)(4) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 1 mol·L-1的Al2(SO4)3溶液中加入100 mL KOH溶液,充分反应得到3.9 g沉淀,则KOH溶液的物质的量浓度可能是( )
①1 mol·L-1 ②3 mol·L-1 ③1.5 mol·L-1 ④3.5 mol·L-1
A.③B.①②C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含![]() 、
、![]() 和惰性杂质。为进一步确定其中
和惰性杂质。为进一步确定其中![]() 、
、![]() 的含量,某同学进行了如下实验:
的含量,某同学进行了如下实验:
① 取2.6g样品,加入200.0mL 0.2000mol/L酸性![]() 溶液,加热(硫元素全部转化为
溶液,加热(硫元素全部转化为![]() ),滤去不溶杂质;
),滤去不溶杂质;
② 收集滤液至250mL容量瓶中,定容;
③ 取25.00mL溶液,用![]() 溶液滴定,消耗20.00mL;
溶液滴定,消耗20.00mL;
④ 加入适量![]() 溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:
溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:![]() ;
;
⑤ 加入2滴淀粉溶液,用![]() 溶液滴定,消耗30.00mL(已知:
溶液滴定,消耗30.00mL(已知:![]() )。
)。
回答下列问题:
(1)写出![]() 溶于酸性
溶于酸性![]() 溶液的离子方程式:____________________________________。
溶液的离子方程式:____________________________________。
(2)配制![]() 溶液时要用煮沸过的稀硫酸,原因是______________________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有_______________。
溶液时要用煮沸过的稀硫酸,原因是______________________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有_______________。
(3)③中取25.00mL待测溶液所用的仪器是_____________。
(4)⑤中滴定至终点时的现象为____________________________。
(5)混合样品中![]() 和
和![]() 的含量分别为_______%、_______%(结果均保留1位小数)。
的含量分别为_______%、_______%(结果均保留1位小数)。
(6)判断下列情况对样品中![]() 和
和![]() 的含量的影响(填“偏高”、“偏低”或“无影响”)若量取酸性
的含量的影响(填“偏高”、“偏低”或“无影响”)若量取酸性![]() 溶液时俯视读数,则最终结果
溶液时俯视读数,则最终结果![]() 的含量_______________。若用
的含量_______________。若用![]() 溶液滴定终点读数时仰视,则最终结果
溶液滴定终点读数时仰视,则最终结果![]() 的含量_____________。
的含量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁铝合金投入100 mL一定浓度的盐酸中,合金即溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积如图所示,由图中数据分析计算:

(1)原合金中镁和铝的质量分别为多少?
(2)盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 31g白磷中含有6NA个P-P
B. 0.1molNa2O2与足量的潮湿的CO2反应转移的电子数目为0.1NA
C. NA个Fe(OH)3胶体粒子的质量为107g
D. 标准状况下,2.24LNO和2.24LO2混合后气体分子数为0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯和硬脂酸甘油酯均是天然油脂的成分。 它们的结构简式如下图所示。
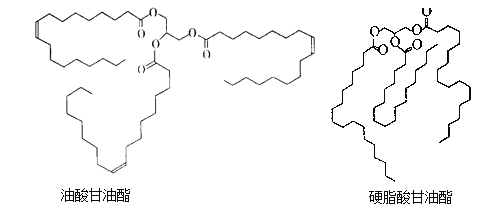
下列说法错误的是
A. 油酸的分子式为C18H34O2
B. 硬脂酸甘油酯的一氯代物共有54种
C. 天然油脂都能在NaOH溶液中发生取代反应
D. 将油酸甘油酯氢化为硬脂酸甘油酯可延长保存时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)该实验探究的是_________________________________因素对化学反应速率的影响。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________ mol·L-1(假设混合溶液的体积为50 mL)。
(3)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②_______________________________
Ⅱ:当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为___________________________________
(2)在恒温恒容密闭容器中,判断上述反应达到平衡状态的依据是________________
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com