
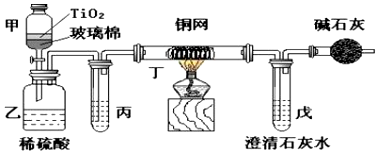
分析 (1)根据题意可知,甲中的反应为NaClO将CN-离子氧化成CNO-;乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2.根据氧化还原反应配平;
(2)饱和食盐水除去氯化氢气体;铜网用来除去氯气;碱石灰作用是吸收空气中二氧化碳防止装置戊吸收二氧化碳产生误差;
(3)根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率;处理的百分率偏低,说明反应生成二氧化碳没有完全生成碳酸钙沉淀.
解答 解:(1)根据题意可知,甲中的反应为NaClO将CN-离子氧化成CNO-,NaClO具有强氧化性,被还原为Cl-,反应离子方程式为CN-+ClO-═CNO-+Cl-;乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:CN-+ClO-═CNO-+Cl-;2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,饱和食盐水能够除去氯化氢杂质;铜网能够和氯气反应从而除去氯气杂质;避免空气中的二氧化碳进入戊装置造成测定数据的干扰,用碱石灰吸收二氧化碳,
故答案为:除去HCl气体;去除Cl2;防止空气中CO2进入戊中影响测定准确度;
(3)200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.0082mol,反应的CN-的物质的量是0.0082mol,CN-被处理的百分率是$\frac{0.0082mol}{0.01mol}$×100%=82%;
该测得值与工业实际处理的百分率相比总是偏低,可能的原因有:①装置乙、丙、丁中可能滞留有CO2、②CO2产生丁速度较快未与戊中丁澄清石灰水充分反应、③Cl2、HCl在丙、丁中未吸收完全等;
能提高准确度的建议有:建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;建议二:乙中瓶塞改为三孔塞,增加丁那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多到与Ca(OH)2反应.建议三:将戊中澄清石灰水改为浓度较大到NaOH溶液,反应结束后戊中加入足量CaCl2后测沉淀质量等,
故答案为:82%;①装置乙、丙、丁中可能滞留有CO2,②CO2产生丁速度较快未与戊中丁澄清石灰水充分反应,③Cl2、HCl在丙、丁中未吸收完全.
点评 本题考查了电镀后的废水中CN-离子的含量测定,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气反应:CH4+Cl2$\stackrel{高温}{→}$CH3Cl+HC1(加成反应) | |
| B. | 乙烯与水在一定条件下生成乙醇:CH2=CH2+H2O$→_{一定条件}^{催化剂}$C3CH2OH(加成反应) | |
| C. | 麦芽糖制葡萄糖:$\stackrel{{C}_{12}{H}_{22}{O}_{11}}{麦芽糖}$+H2O$\stackrel{稀硫酸}{→}$$\stackrel{2{C}_{6}{H}_{12}{O}_{6}}{葡萄糖}$(氧化反应) | |
| D. | 乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+3NH3+2Ag↓+H2O(取代反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ce元素位于元素周期表第六周期第IIIB族 | |
| B. | ${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
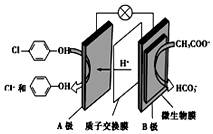 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( 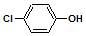 )的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )| A. | B极是电解池的负极 | |
| B. | 电子从A极沿导线经小灯泡流向B极 | |
| C. | A极的电极反应式为: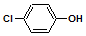 +e-═Cl-+ +e-═Cl-+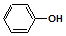 | |
| D. | 当外电路中有1 mol e-转移时,通过质子交换膜的H+为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com