
| װ�� | 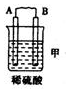 |  |  |
| ���� | ���۽���A�����ܽ� | C���������� | A����������� |
���� ��1����װ���У����۽���A�����ܽ�˵����װ�ù�����ԭ��أ���Aʧ���ӷ���������Ӧ����������B������������C���������ӣ�˵��C��ͭ���ӵõ��ӷ�����ԭ��Ӧ����C��ԭ���������B����������װ����A�������������˵��A�������ӵõ��ӷ�����ԭ��Ӧ����A��ԭ���������D����������ԭ��ظ����Ľ�����Դ������������������Խ������ǿ��˳���ǣ�D��A��B��C��
��2����ZnһCuһ������Һ��ɵ�ԭ��أ�����һ��ʱ���пƬ������������6.5g����Һ�е�H+���������������ĵ缫��Ӧʽ�Ǹ�����ӦΪZn-2e-=Zn2+�����ݵ��ӵ�ʧ�غ��г���ϵʽ���������
��� �⣺��1������װ���У����۽���A�����ܽ�˵����װ�ù�����ԭ��أ���Aʧ���ӷ���������Ӧ����������B������������C���������ӣ�˵��C��ͭ���ӵõ��ӷ�����ԭ��Ӧ����C��ԭ���������B����������װ����A�������������˵��A�������ӵõ��ӷ�����ԭ��Ӧ����A��ԭ���������D����������ԭ��ظ����Ľ�����Դ������������������Խ������ǿ��˳���ǣ�D��A��B��C��
����װ���У�C����������˵��C�缫��ͭ���ӵõ��ӷ�����ԭ��Ӧ����C���������缫��ӦʽΪCu2++2e-�TCu��
�ʴ�Ϊ��Cu2++2e-�TCu��
��ͨ�����Ϸ���֪�����ֽ������ǿ��˳����D��A��B��C���ʴ�Ϊ��D��A��B��C��
��2����ZnһCuһ������Һ��ɵ�ԭ��أ�����һ��ʱ���пƬ������������6.5g����Һ�е�H+���������������ĵ缫��Ӧʽ�Ǹ�����ӦΪZn-2e-=Zn2+�����ݷ�Ӧ�е����غ㣬��״��������$\frac{6.5g}{65g/mol}$��22.4=2.24L���壬�ʴ�Ϊ��������Zn-2e-=Zn2+��2.24L��
���� ���⿼����ԭ���ԭ��������ԭ��ص缫�ϵ�ʧ�������ж���������һ����˵����ԭ��ظ����Ľ����������˳��ǿ���йص缫��Ӧʽ����д�ͼļ��㣬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶��Ͻ�ѧ�ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
���ݼ۲���ӶԻ������ۼ�ԭ�ӵ��ӻ������ж�NF3���ӵĿռ乹�ͺ�����ԭ�ӵ��ӻ���ʽΪ
A��ֱ���� sp�ӻ� 
 B�������� sp2�ӻ�
B�������� sp2�ӻ�
C�������� sp2�ӻ� D�������� sp3�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪ H+��aq��+OH-��aq���TH O��l����H=-57.3kJ•mol-1���ش������й��кͷ�Ӧ�����⣺��1���� 0.1mol Ba��OH��2 ���ϡ��Һ������ϡ���ᷴӦ���ܷų�11.46kJ ��������
��֪ H+��aq��+OH-��aq���TH O��l����H=-57.3kJ•mol-1���ش������й��кͷ�Ӧ�����⣺��1���� 0.1mol Ba��OH��2 ���ϡ��Һ������ϡ���ᷴӦ���ܷų�11.46kJ ���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4��HCl����AgNO3��Һ������ | B�� | KNO3��K2SO4����Ba��NO3��2��Һ������ | ||
| C�� | Cu��CuO�������ᡢ���� | D�� | CaCO3��CaO������һЩˮ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H5OH��1��+3O2��g��=2CO2��g��+3H2O��g�� ����H=-1367.0 kJ/mol��ȼ���ȣ� | |
| B�� | NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��1������H=+57.3 kJ/mol ���к��ȣ� | |
| C�� | S��s��+O2��g��=SO2��g�� ����H=-269.8 kJ/mol ����Ӧ�ȣ� | |
| D�� | 2NO2=O2+2NO ����H=+116.2 kJ/mol ����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����AgNO3��Һ�а�ɫ�������ɣ�֤��ԭ��Һ��һ����Cl- | |
| B�� | ����ϡHNO3�ữ��BaCl2��Һ���а�ɫ�������ɣ�֤��ԭ��Һ��һ����SO42- | |
| C�� | ��ij��Һ�м���Ba��NO3��2��Һ�����������ٵ��뼸�������ữ��AgNO3��Һ��������ɫ������˵��ԭ��Һ�к���Cl- | |
| D�� | ��֪��ͪ����ɫҺ�壬������ˮ���ܶ�С��ˮ������ˮ�ͱ�ͪ�����������Ϊ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��֪ij���淴Ӧ��mA��g��+nB��g��?pC��g����H=Q kJ•mol-1�����ܱ������н��У���ͼ��ʾ�ڲ�ͬʱ��t���¶�T��ѹǿP�뷴Ӧ��B�İٷֺ����Ĺ�ϵ���ߣ������ж���ȷ���ǣ�������
��֪ij���淴Ӧ��mA��g��+nB��g��?pC��g����H=Q kJ•mol-1�����ܱ������н��У���ͼ��ʾ�ڲ�ͬʱ��t���¶�T��ѹǿP�뷴Ӧ��B�İٷֺ����Ĺ�ϵ���ߣ������ж���ȷ���ǣ�������| A�� | T1��T2��P1��P2��m+n��p������0 | B�� | T1��T2��P1��P2��m+n��p������0 | ||
| C�� | T1��T2��P1��P2��m+n��p������0 | D�� | T1��T2��P1��P2��m+n��p������0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com