
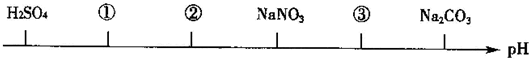
| A. | CuCl2 CH3COOH NaOH | B. | HCl H2SO3 NaHCO3 | ||
| C. | HF HCl CH3COONa | D. | NH4Cl HCl CH3COONa |
分析 硫酸是强酸,其溶液呈酸性,硝酸钠是强酸强碱盐,其溶液呈中性,碳酸钠是强碱弱酸盐,其溶液呈碱性,根据图知,①②溶液呈酸性,且①的酸性大于②,则如果都是酸时,①中酸的电离程度大于②,如果是酸和盐时,则①是酸,②是盐,③溶液呈弱碱性,应该为盐溶液,且酸根离子的水解程度小于碳酸根离子.
解答 解:硫酸是强酸,其溶液呈酸性,硝酸钠是强酸强碱盐,其溶液呈中性,碳酸钠是强碱弱酸盐,其溶液呈碱性,根据图知,①②溶液呈酸性,且①的酸性大于②,则如果都是酸时,①中酸的电离程度大于②,如果是酸和盐时,则①是酸,②是盐,③溶液呈弱碱性,应该为盐溶液,且酸根离子的水解程度小于碳酸根离子.
A、相同浓度的CuCl2的pH应该比 CH3COOH的大,且NaOH的pH应该比碳酸钠大,故A错误;
B、HCl是强酸,完全电离,而H2SO3是弱酸,部分电离,故相同浓度的HCl的pH小于H2SO3,NaHCO3是强碱弱酸盐,水解显碱性,且由于其对应的酸为H2CO3,酸性强于碳酸钠对应的酸HCO3-的酸性,根据“越弱越水解”的规律可知,NaHCO3的碱性弱于碳酸钠,故B正确;
C、HF为弱酸,HCl为强酸,故HF的pH不可能比HCl的小,故C错误;
D、NH4Cl是因为水解显酸性,HCl是强酸,故NH4Cl的pH不可能比HCl小,故D错误.
故选B.
点评 本题考查了弱电解质的电离、盐类的水解等知识点,题目难度中等,明确等浓度时,酸的强弱与溶液pH的关系、盐类水解程度与溶液pH的关系是解本题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com