£Ø2009?µ¤¶«Ä£Äā£©¼×“¼æÉŅŌÓėĖ®ÕōĘų·“Ӧɜ³ÉĒāĘų£¬·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ
CH
3OH£Øg£©+H
2O£Øg£©?CO
2£Øg£©+3H
2£Øg£©£»”÷H£¾0
£Ø1£©Ņ»¶ØĢõ¼žĻĀ£¬ĻņĢå»żĪŖ2LµÄŗćČŻĘ÷ĆܱÕČŻĘ÷ÖŠ³äČė1molCH
3OH£Øg£©ŗĶ3molH
2O£Øg£©£¬20sŗ󣬲āµĆ»ģŗĻĘųĢåµÄŃ¹ĒæŹĒ·“Ó¦Ē°µÄ1.2±¶£¬ŌņÓĆ¼×“¼±ķŹ¾øĆ·“Ó¦µÄĖŁĀŹĪŖ
0.01mol/L?s
0.01mol/L?s
£®
£Ø2£©ÅŠ¶Ļ£Ø1£©ÖŠæÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ£ØĢīŠņŗÅ£©
¢Ū¢Ü
¢Ū¢Ü
£®
¢Łv
Õż£ØCH
3OH£©=v
Õż£ØCO
2£©
¢Ś»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä
¢Ū»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä
¢ÜCH
3OHӢH
2OӢCO
2ӢH
2µÄÅØ¶Č¶¼²»ŌŁ·¢Éś±ä»Æ
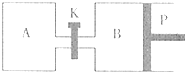
£Ø3£©ČēĶ¼ÖŠPŹĒæÉ×ŌÓÉĘ½ŠŠ»¬¶ÆµÄ»īČū£¬¹Ų±ÕK£¬ŌŚĻąĶ¬ĪĀ¶ČŹ±£¬ĻņAČŻĘ÷ÖŠ³äČė1molCH
2OH£Øg£©ŗĶ2molH
2O£Øg£©£¬ĻņBČŻĘ÷ÖŠ³äČė1.2molCH
3OH£Øg£©ŗĶ2.4molH
2O£Øg£©£¬Į½ČŻĘ÷·Ö±š·¢ÉśÉĻŹö·“Ó¦£®
ŅŃÖŖĘšŹ¼Ź±ČŻĘ÷AŗĶBµÄĢå»ż¾łĪŖaL£®ŹŌ»Ų“š£ŗ
¢Ł·“Ó¦“ļµ½Ę½ŗāŹ±ČŻĘ÷BµÄĢå»żĪŖ1.5aL£¬ČŻĘ÷BÖŠCH
3OH×Ŗ»ÆĀŹĪŖ
75%
75%
A”¢BĮ½ČŻĘ÷ÖŠH
2O£Øg£©µÄĢå»ż°Ł·Öŗ¬ĮæµÄ“󊔹ŲĻµĪŖ£ŗB£ØĢī”°£¾”±”¢”°£¼”±”¢”°=”±£©
£¼
£¼
A£®
¢ŚČō“ņæŖK£¬Ņ»¶ĪŹ±¼äŗóÖŲŠĀ“ļµ½Ę½ŗā£¬ČŻĘ÷BµÄĢå»żĪŖ
1.75a
1.75a
L£ØĮ¬ĶعÜÖŠĘųĢåĢå»żŗöĀŌ²»¼Ę£¬ĒŅ²»æ¼ĀĒĪĀ¶ČµÄÓ°Ļģ£©£®

 £Ø2009?µ¤¶«Ä£Äā£©¼×“¼æÉŅŌÓėĖ®ÕōĘų·“Ӧɜ³ÉĒāĘų£¬·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ
£Ø2009?µ¤¶«Ä£Äā£©¼×“¼æÉŅŌÓėĖ®ÕōĘų·“Ӧɜ³ÉĒāĘų£¬·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ


 £Ø2009?µ¤¶«Ä£Äā£©Ēėøł¾Ż¹¤ŅµÖĘĮņĖįµÄÓŠ¹ŲÖŖŹ¶»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø2009?µ¤¶«Ä£Äā£©Ēėøł¾Ż¹¤ŅµÖĘĮņĖįµÄÓŠ¹ŲÖŖŹ¶»Ų“šĻĀĮŠĪŹĢā£ŗ


