
| A. | ①② | B. | ②④ | C. | ③④ | D. | ④⑤ |
分析 油脂是高级脂肪酸的甘油酯,即属于酯类,根据高级脂肪酸是饱和的高级脂肪酸还是不饱和的高级脂肪酸,油脂可以分为脂肪和油,若为不饱和的高级脂肪酸甘油酯,则能和氢气发生加成反应;在油脂中,若所含的烃基不同,则为混甘油酯,若烃基相同,则为单甘油酯;天然的油脂均为混甘油酯,据此分析.
解答 解:①油脂是饱和的高级脂肪酸或不饱和的高级脂肪酸与甘油形成的酯,故①正确;
②油脂是高级脂肪酸与甘油形成的酯,故属于酯类,故②正确;
③油脂可以分为脂肪和油,油是由不饱和的高级脂肪酸与甘油形成的酯,能发生氢化反应,但脂肪是由饱和的高级脂肪酸和甘油形成的酯,不能发生氢化反应,故③错误;
④某油脂分子中,所含烃基有三种,但每一个油脂分子中所含的三种烃基都相同,则此油脂为混甘油酯,但不是混合物,是纯净物,故④错误;
⑤天然油脂是混合物,无固定熔沸点,故⑤正确.
故选C.
点评 本题考查油脂的性质、组成与结构,难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:多选题
| A. | 少量二氧化硫气体通入到漂白粉溶液中;Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| B. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 少量的钠投入足量的水中:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前,盐酸和醋酸溶液中:c(Cl?)<c(CH3COO-) | |
| B. | 分别加入10.00 mL NaOH溶液时,测得醋酸反应后所得溶液pH=6,则溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | 当两种溶液的pH均等于7时,两种酸所消耗NaOH溶液体积不相等,醋酸消耗的NaOH溶液体积多 | |
| D. | 加入20.00 mL NaOH溶液时,所得两种溶液中:c(Cl?)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医院里消毒用的来苏水,其主要成分是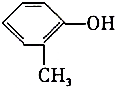 ,它属于酚类 ,它属于酚类 | |
| B. | 护肤用的甘油( )属于三元醇 )属于三元醇 | |
| C. | 冬天汽车里用的防冻液是乙醇 | |
| D. | 含有-OH(羟基)官能团的有机物不一定是醇类 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C4H6O3,每摩尔该物质充分燃烧需消耗4mol O2 | |
| B. | 能发生取代、加成、氧化、加聚、中和等反应 | |
| C. | 分别与足量Na、NaOH、Na2CO3反应,生成物均为NaOOC-CH═CH-CH2OH | |
| D. | 该分子含有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、淀粉、脂肪、蛋白质都是高分子化合物 | |
| B. | 淀粉水解的最终产物都能发生银镜反应 | |
| C. | 误食重金属盐而引起的中毒可服用大量豆浆或牛奶进行解救 | |
| D. | 脂肪能发生皂化反应,生成甘油和高级脂肪酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
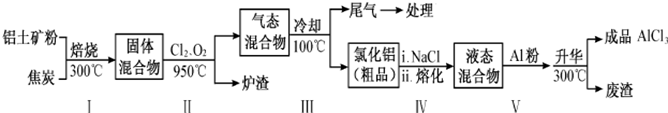
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
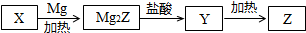
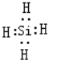 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1803 年道尔顿提出的“元素的原子以其原子质量为特征” | |
| B. | 1808 年盖•吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子” | |
| C. | 1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“ | |
| D. | 1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com