
| A. | X2-的离子半径大于Y+的离子半径 | |
| B. | H2Z的沸点高于H2X | |
| C. | Z的简单气态氢化物稳定性比W的强 | |
| D. | Y2X2和Y2Z的晶体类型和化学键类型完全相同 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,Y元素的焰色为黄色,则Y为Na,Z元素的最高价为+6,则Z为S元素,W原子序数最大,故W为Cl,而X与Z原子序数相差8,则X为O元素,据此解答.
解答 解:短周期主族元素X、Y、Z、W原子序数依次增大,Y元素的焰色为黄色,则Y为Na,Z元素的最高价为+6,则Z为S元素,W原子序数最大,故W为Cl,而X与Z原子序数相差8,则X为O元素.
A.O2-、Na+离子的电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+,故A正确;
B.H2O分子之间存在氢键,水的沸点高于H2S,故B错误;
C.非金属性S<Cl,故氢化物稳定性H2S<HCl,故C错误;
D.Na2O2含有离子键、共价键,Na2S只含有离子键,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意元素周期律的理解应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 丙烯能发生加成反应,还能使酸性KMnO4溶液褪色 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
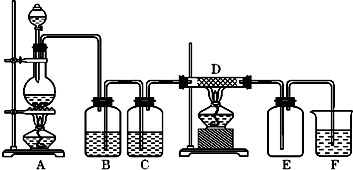
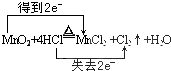 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
“人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,光能和电能全部转化为化学能 | |
| B. | 该装置工作时,H+向b极板移动 | |
| C. | 反应6CO2+8H2O$\frac{\underline{\;\;\;光\;\;\;}}{通电}$2C3H8O+9O2,每消耗1 mol CO2 转移4 mol电子 | |
| D. | 电极a上CO2参与的电极反应为:3CO2+18H++18e-═C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 原因 |
| A | Fe与稀HNO3、稀H2SO4反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | 重金属盐中毒可服用牛奶解毒 | 牛奶中蛋白质变性,保护了人体的蛋白质 |
| D | 明矾用来净水 | Al3+水解生成Al(OH)3胶体,具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com