
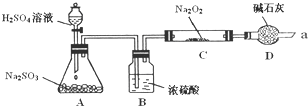
 某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
| m2-m1 |
| 64 |
| m2-m1 |
| 64 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
A、 称量氢氧化钠固体 |
B、 检验铁粉与水蒸气反应产生的氢气 |
C、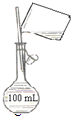 配制150mL 0.10 mol?L-1盐酸 |
D、 分离两种沸点相差较大的液体互溶混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
 历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的( )
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的( )| A、靛蓝由碳、氢、氧、氮四种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、该物质是高分子化合物 |
| D、它是芳香族有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com