
����Ŀ������Ѫѹҩ����ɳ̹��һ�ֽṹ���ӵ��л��H�Ǻϳ���ɳ̹��һ���м��壬��ϳ�·�����£�

��֪��I.
II. ���ʹ��ɷ������½�����Ӧ��
��1���л���H�к��������ŵ�������_________��
��2��C![]() D �ķ�Ӧ������_________��
D �ķ�Ӧ������_________��
��3��A�DZ���һԪ����A![]() B��Ӧ�Ļ�ѧ����ʽΪ_________��
B��Ӧ�Ļ�ѧ����ʽΪ_________��
��4��1 mol Eˮ������2 mol CH3OH��E�Ľṹ��ʽ��__________��
��5��E���Ҷ�����һ���������ܹ�������Ӧ���ɾۺ��д���˷�Ӧ�Ļ�ѧ����ʽ_________��
��6��ͨ���ಽ��Ӧ����E����������-NH2�ɵõ�F��F���Ӵ��ڽϺõĶԳƹ�ϵ��F�Ľṹ��ʽ��_________��
��7������˵����ȷ����_______��������ĸ��
a��A�ܷ���ȡ����Ӧ��������Ӧ����ȥ��Ӧ
b��1 mol H��������������Һ��Ӧ��������1 mol Ag
c����֪ϩ��ʽ�ṹ![]() ���ȶ�����Gȴ�����ȶ����ڣ���ԭ����������ڻ��ż���Ӱ��
���ȶ�����Gȴ�����ȶ����ڣ���ԭ����������ڻ��ż���Ӱ��
��8��д��ͬʱ��������������F��һ��ͬ���칹��Ľṹ��ʽ_________��
a����F������ͬ��������Ĺ�����
b���ܷ���������Ӧ
c����˴Ź���������ʾ�����ֲ�ͬ��ѧ�������⣬�������Ϊ2��4��1��2
���𰸡� ȩ�� �ӳɷ�Ӧ CH3CH2CH2CH2OH + HBr![]() CH3CH2CH2CH2Br + H2O CH2(COOCH3)2
CH3CH2CH2CH2Br + H2O CH2(COOCH3)2  H3COOCCH(NH2)COOCH3 ac HCOOCH2CH(NH2)CH2OOCH
H3COOCCH(NH2)COOCH3 ac HCOOCH2CH(NH2)CH2OOCH
����������1����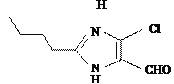 ֪�л���H�к��������ŵ�������ȩ����
֪�л���H�к��������ŵ�������ȩ����
��2����![]()
![]()
![]() ����֪C
����֪C![]() D �ķ�Ӧ�����Ǽӳɷ�Ӧ��
D �ķ�Ӧ�����Ǽӳɷ�Ӧ��
��3��A�DZ���һԪ����A![]() B(
B(![]() ���Ǵ���±������ȡ����Ӧ����G
���Ǵ���±������ȡ����Ӧ����G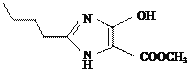 �Ľṹ֪֪AΪ CH3CH2CH2CH2OH ����A
�Ľṹ֪֪AΪ CH3CH2CH2CH2OH ����A![]() B��Ӧ�Ļ�ѧ����ʽΪ��CH3CH2CH2CH2OH + HBr
B��Ӧ�Ļ�ѧ����ʽΪ��CH3CH2CH2CH2OH + HBr![]() CH3CH2CH2CH2Br + H2O
CH3CH2CH2CH2Br + H2O
��4����1 mol Eˮ������2 mol CH3OH��˵��E�к�������������E�ķ���ʽΪ![]() ����E�Ľṹ��ʽ��CH2(COOCH3)2��
����E�Ľṹ��ʽ��CH2(COOCH3)2��
��5������֪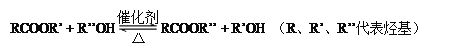 E�ĽṹʽΪCH2(COOCH3)2���Ҷ�����һ���������ܹ�������Ӧ���ɾۺ���˷�Ӧ�Ļ�ѧ����ʽ
E�ĽṹʽΪCH2(COOCH3)2���Ҷ�����һ���������ܹ�������Ӧ���ɾۺ���˷�Ӧ�Ļ�ѧ����ʽ
��6����ΪE�Ľṹ��ʽ��CH2(COOCH3)2����E![]() F
F![]() ��֪
��֪ F���Ӵ��ڽϺõĶԳƹ�ϵ������F�Ľṹ��ʽ��H3COOCCH(NH2)COOCH3��
F���Ӵ��ڽϺõĶԳƹ�ϵ������F�Ľṹ��ʽ��H3COOCCH(NH2)COOCH3��
��7��a��A�ĽṹʽΪCH3CH2CH2CH2OH�����ǻ��������ܷ���ȡ����Ӧ��������Ӧ����ȥ��Ӧ����a��ȷ��b����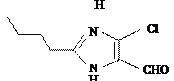 �к���һ��ȩ��������1 mol H��������������Һ��Ӧ��������2 mol Ag����b����c����֪ϩ��ʽ�ṹ
�к���һ��ȩ��������1 mol H��������������Һ��Ӧ��������2 mol Ag����b����c����֪ϩ��ʽ�ṹ![]() ���ȶ����Ľṹʽ
���ȶ����Ľṹʽ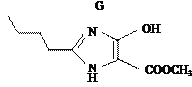 ��Gȴ�����ȶ����ڣ���ԭ����������ڻ��ż���Ӱ�� ����c�ԣ�
��Gȴ�����ȶ����ڣ���ԭ����������ڻ��ż���Ӱ�� ����c�ԣ�
��8����ΪF�Ľṹ��ʽH3COOCCH(NH2)COOCH3 ������������ ��һ�����������Է���a����F������ͬ��������Ĺ����ż������������� ��һ�������� b���ܷ���������Ӧ����ȩ��c����˴Ź���������ʾ�����ֲ�ͬ��ѧ�������⣬�������Ϊ2��4��1��2��ͬ���칹��Ϊ��HCOOCH2CH(NH2)CH2OOCH



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ��2 L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ͼ������

��1���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________________��
��2����Ӧ��ʼ��2min����Z��ʾ��ƽ����Ӧ����Ϊ____________________��
��3����ͬ�����µĸ÷�Ӧ�����ʣ���v(X)��0.3 mol��L��1��s��1����v(Z)��0.1 mol��L��1��s��1����v(Y)��0.2 mol��L��1��s��1�����з�Ӧ����������________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���Ԫ�ؼ��仯��������ʾ�����Ҫ���壮
��1���������ӵĽṹʾ��ͼΪ �� �ڼ���ʱ����Ԫ�ص�����������Ӧˮ�����Ũ��Һ��ľ̿��Ӧ�Ļ�ѧ����ʽΪ ��
��2��25�棬��0.10molL��1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c��S2������ϵ��ͼ��������Һ����ı仯��H2S�Ļӷ����� 
��pH=13ʱ����Һ�е�c��H2S��+c��HS����=molL��1 ��
��ij��Һ��0.020molL��1Mn2+��0.10molL��1H2S������ҺPH=ʱ��Mn2+��ʼ������[��֪��Ksp��MnS��=2.8��10��13]
��3��25�棬������ĵ���ƽ�ⳣ�������
Ka1 | Ka2 | |
H2SO3 | 1.3��10��2 | 6.3��10��8 |
H2CO3 | 4.2��10��7 | 5.6��10��11 |
��HSO3���ĵ���ƽ�ⳣ������ʽK= ��
��0.10molL��1Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ ��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����VmL pH=a�Ĵ����еμ�pH=b��NaOH��ҺVmLʱ������ǡ����ȫ��Ӧ������˵����ȷ���ǣ�������
A.��ʱa+b��ֵ�Ǵ���14
B.��Ӧ����Һ������
C.��Ӧ����Һ����ˮ�����c��H+��С��10��7mol/L
D.��Ӧǰ�����NaOH��ˮ�ĵ���Ӱ��̶�һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ�Ӧ����ʽ����ȷ����(����)
A. ������������γɻ��漰��Ӧ��2H2SO3��O2===4H����2SO![]()
B. �ȵĴ�����Һ������ϴ���۵�ԭ��CO![]() ��2H2O
��2H2O![]() H2CO3��2OH��
H2CO3��2OH��
C. ʢ��NaOH��Һ���Լ�ƿ�����ò�������SiO2��2OH��===SiO![]() ��H2O
��H2O
D. �ɷ�Ϊ����Ľ������84����Һ���ʹ�����ж���Cl����ClO����2H��===Cl2����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ����ֳ�����ô���������У����������𣿷��������ή��GDP�ġ��ڷ������������з�����( )
A.���ȵ�������ԭ��Ӧ
B.���ȵķ�������ԭ��Ӧ
C.���ȵ�������ԭ��Ӧ
D.���ȵķ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���ӦN2+3H22NH3 �� ��2L�ܱ������н��У�5min�ڰ�������������1.7g����Ӧ����Ϊ��������
A.v��H2��=0.03 mol/��Lmin��
B.v��N2��=0.02mol/��Lmin��
C.v��NH3��=0.17mol/��Lmin��
D.v��NH3��=0.01mol/��Lmin��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йش����Ĵ�����������ɴ����Ҵ�������ʵ�����õ�һЩ��ʶ����ʵ��װ����ͼ��ʾ����ʵ�����ΪԤ��ʹ���Ž��Ҵ���������ͼʾ��װ��װ�ã���ͭ˿���м䲿�ּ��ȣ�Ƭ�̺�ʼ(��Ъ��)������������ɹ۲쵽���Ե�ʵ������

��ش��������⣺
��1�������ȵ�ͭ˿��������Ӧ�Ļ�ѧ����ʽΪ________________________________��
��2����A���пɹ۲쵽____________��ʵ�������п���ʶ���ڸ�ʵ������У������μ��˻�ѧ��Ӧ��������ʶ�������������ʱ��Ҫһ����_______________________��
��3��ʵ��һ��ʱ�����������ƾ��ƣ���Ӧ���ܷ�������У�__________��ԭ���Ȳ��ֵ�ͭ˿��ʲô����____________������������������Ϊ_________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com