
 2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����
2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����| A��H��H��N��N���ι� |
| B��N��N����ԼΪ946 kJ/mol |
| C���ϳɰ���Ӧѡ���ʵ��Ĵ�����Ϊ�����H2��ת���� |
| D��0.5 mol N2��1.5 mol H2����������³�ַ�Ӧ���ų�����Ϊ46.2 kJ |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����֪C(ʯī, s)=C(���ʯ, s) ��H��0������ʯ��ʯī�ȶ� |
| B����֪C(s)+O2(g)=CO2(g) ��H1��C(s)+1/2O2(g)=CO(g) ��H2����H2����H1 |
| C����֪2H2(g)+O2(g)=2H2O(g) ��H=" -483.6" kJ/mol����������ȼ����Ϊ241.8kJ/mol |
| D����֪NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ��H=-57.3kJ/mol����20gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��к���Ϊ28.65kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CS2 | B��H2S | C��SO2 | D��SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����֪2H2��g����O2��g��= 2H2O��g������H=��483��6 kJ/mol����������ȼ����Ϊ241��8 kJ/mol |
| B����֪C��ʯī��s��= C�����ʯ��s������H��0������ʯ��ʯī�ȶ� |
| C����20��0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28��7 kJ����������÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��NaOH��aq����HCl��aq��=NaCl��aq����H2O��aq������H=��57.4 kJ/mol |
| D����֪2C��s����2O2��g��=2CO2��g������H1��2C��s����O2��g��=2CO��g�� ����H2�����H1<��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
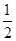 O2��g��=H2O��g������H=" a" kJ/mol
O2��g��=H2O��g������H=" a" kJ/mol 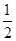 O2��g��=H2O��l������H=" b" kJ/mol
O2��g��=H2O��l������H=" b" kJ/mol| A�����Ƕ������ȷ�Ӧ | B��a��b��c��Ϊ��ֵ |
| C����Ӧ�ȵĹ�ϵ��a=b | D����Ӧ�ȵĹ�ϵ��2b=c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ȵ�б���ȶ� |
| B��S(s����б)=S(s������)��H3����0��33 kJ/mol |
| C����ͬ���ʵ�����������ȵ�б�������е������� |
| D����ʽ��ʾ����1 mol O2�еĹ��ۼ������յ��������γ�1 mol SO2�еĹ��ۼ����ų���������297��16 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���Ҽ��ͦм������ڹ��ۼ�������һ�ֻ�ѧ�� |
| B��s��s�Ҽ���s��p�Ҽ��ĵ����ƾ�Ϊ��Գ�ͼ�� |
| C�������к��й��ۼ��������ٺ���һ���Ҽ� |
| D�����Цм��Ļ�������ֻ���Ҽ��Ļ�����Ļ�ѧ���ʲ�ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ʵ������������������ֱ���ȫȼ�գ����߷ų������� |
| B����C��ʯī��=C�����ʯ����H="+1.90" kJ��mol-1��֪�����ʯ��ʯī�ȶ� |
| C����ϡ��Һ�У�H+��aq����+OH-��aq����=H2O��l����H=��57.3 kJ��mol-1��������0.5 molH2SO4��Ũ�����뺬1 mol NaOH����Һ��ϣ��ų����ȴ���57.3 kJ |
| D����101 kPaʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2 H2��g��+O2��g��="2" H2O��1����H=��285.8 kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com