
分析 (1)根据氧化还原反应中氧化剂和还原剂的特点和性质来寻找反应物和生成物,然后结合化合价升降相等配平;根据所发生的反应来分析化合价的变化情况,进而得到转移电子的数目;
(2)根据原子守恒来确定物质的化学式,双氧水做氧化剂的还原产物为水,无污染产物.
解答 解:(1)该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,高锰酸根离子中锰元素从+7变为+2价,化合价降低5价,双氧水中氧元素化合价从-1价变为0价,化合价至少升高2价,则高锰酸根离子的系数为2,双氧水的系数为5,然后利用质量守恒配平可得该反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,双氧水中-1价的氧变为氧气中的0价,当生成6.72L(标准状况)即0.3mol氧气时,则失电子数目为:0.3mol×2×(1-0)=0.6mol,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;0.6;
(2)反应KCN+H2O2+H2O=A+NH3↑遵循原子守恒,所以A为KHCO3,双氧水做氧化剂的还原产物为水,无污染,
故答案为:KHCO3;H2O2是氧化剂,其还原产物是水,水没有毒性及污染性.
点评 本题是一道有关氧化还原反应知识的综合型题目,注意元素化合价的判断,题目较为综合,难度中等,思维含量大.


科目:高中化学 来源: 题型:解答题
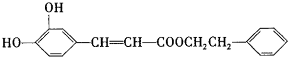 )是一种天然抗癌药物,在一定条件下能发生如下转化
)是一种天然抗癌药物,在一定条件下能发生如下转化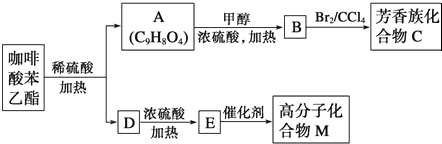
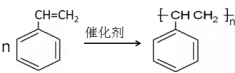 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

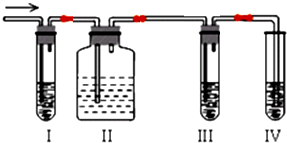
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
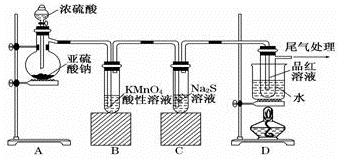
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
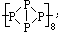 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 是一种极性分子易溶于水 | |
| B. | 分子中,每个磷原子以3个共价键结合3个磷原子 | |
| C. | 相对分子质量8倍于白磷分子 | |
| D. | 它和白磷都是磷的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用C8H18萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 | |
| B. | 有机物一定含碳、氢元素,可能含有氧、硫等元素 | |
| C. | 在石油的分馏实验中,温度计的水银球插入石油中以测液体的温度 | |
| D. | 石油的裂化、裂解、分馏与煤的干馏均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 1.5molC+0.5molD | ||
| C. | 1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com