
| A. | 改变外界条件不能改变化学反应的限度 | |
| B. | 当某反应在一定条件下达到反应限度时即达到化学平衡状态 | |
| C. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| D. | 能自发进行的反应其速率都很大 |
分析 A.外界条件改变,如正逆反应速率不等,则化学反应的限度改变;
B.对于可逆反应,反应的最大限度即为正逆反应速率相等,也就是处于平衡状态;
C.浓度、压强不改变活化分子百分数;
D.能自发进行的反应速率不一定大.
解答 解:A.对于可逆反应,反应的最大限度即为正逆反应速率相等,也就是处于平衡状态,当外界条件改时,正逆反应速率可以改变,反应限度也改变,故A错误;
B.对于可逆反应,反应的最大限度即为正逆反应速率相等,也就是处于平衡状态,故B正确;
C.浓度、压强不改变活化分子百分数,只概念单位体积的活化分子数目,故C错误;
D.反应能否自发进行,取决于焓变和熵变,与反应速率无关,故D错误.
故选B.
点评 本题主要考查化学平衡的特征及影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,难度不大,解题时注意基本概念和基本原理的运用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
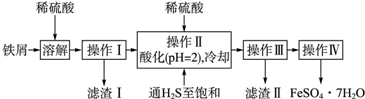
| 25℃时 | pH[] |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为296×10-3mol•L-1•s-1 | |
| B. | 该温度下的反应平衡时N2O5的转化率为29.6% | |
| C. | 1000s后,其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)<5.00mol/L | |
| D. | 反应达平衡后,其他条件不变,升高温度平衡常数将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| v正 | v逆 | 平衡常数K | 转化率α |
| 增大 | 增大 | 减小 | 减小 |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可以提高CO的转化率 | |
| B. | 加入催化剂能提高CO的转化率 | |
| C. | 缩小反应器容积可以使平衡正向移动 | |
| D. | 再充入适量H2,该反应平衡常数的数值会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
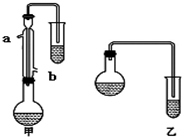 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
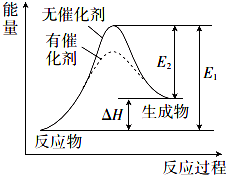 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变(△H) | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com