
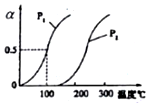
 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
分析 (1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=$\frac{△c}{△t}$计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
平衡常数K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$,计算出平衡时,各组分的浓度,代入平衡常数计算;
③降低温度,正逆反应速率都减小;
(2)④混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,正反应是气体物质的量减小的反应;
⑤容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析;
⑥寻找合成甲醇的温度和压强的适宜条件,先控制温度相同,比较压强;再控制压强相同,比较温度,其它因素不变,以此来解答.
解答 解:(1)①v(H2)=3v(CH4)=3×$\frac{\frac{1.0mol×0.5}{100L}}{5min}$=0.0030mol•L-1•min-1,
故答案为:0.0030mol•L-1•min-1;
②根据化学方程式可以得出,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以去200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
100℃时平衡常数K=$\frac{0.005×(0.015)^{3}}{0.005×0.015}$(mol/L)2=2.25×10-4 (mol/L)2,
故答案为:<;2.25×10-4;
③降低温度,正逆反应速率都减小,故答案为:减小;
(2)④混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,所以△H<0;正反应是气体物质的量减小的反应,气体的物质的量越多,其熵越大,所以△S<0,
故答案为:<;<;
⑤A.该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B.将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C.充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D.再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故答案为:BD;
⑥由控制变量法可知,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,$\frac{n(CO)}{n({H}_{2})}$保持不变,均为$\frac{1}{3}$,比较使用ⅰ、ⅱ,压强不同,所以温度应相同,应为150℃,
故答案为:150;$\frac{1}{3}$;$\frac{1}{3}$.
点评 本题考查化学平衡的计算,为高频考点,把握图象分析、速率及K的计算、平衡移动、控制变量法为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ② | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
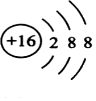 .
.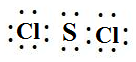 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.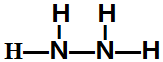 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 由淀粉得到葡萄糖 | 发生了水解反应 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com