
化学物质在生活中有着广泛的应用,下列对应关系错误的是
选项 | 性质 | 应用 |
A | 镁铝合金强度大、质量轻、抗腐蚀能力强 | 制造飞机 |
B | 晶体硅化学性质稳定,能导电 | 制造光纤 |
C | 稀硫酸能与Fe2O3反应 | 除去钢铁表面的铁锈 |
D | NaHCO3受热易分解 | 作焙制糕点的发酵粉 |
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
在体积均为1.0 L的恒容两个密闭容器中分别 加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
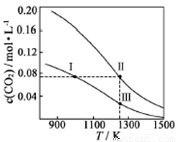
A.化学平衡常数K:K(状态I) < K(状态II) <K(状态III)
B.CO2的平衡转化率α:α(状态I) <α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ) < 2c (CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)> v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:实验题
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。

A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通 入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:  。
。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学 进行了步骤③的实验。
进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上期中化学卷(解析版) 题型:实验题
某废催化剂中主要含SiO2、ZnO、CuS及少量的Fe3O4。某同学以该废催化剂为原料制备皓矾(ZnSO4·7H2O)和蓝矾(CuSO4·5H2O)的实验流程如图所示。

已知:CuS不溶于稀硫酸。
(1)滤渣1的主要成分为________(填化学式)。
(2)实验室用浓H2SO4配制250mL0.50mol/L硫酸溶液时,不需要用到的仪器是________ (填字母)。
A.玻璃棒 B.胶头滴管 C.漏斗 D.容量瓶 e.天平 f.烧杯
(3)现有KMnO4溶液、NaOH溶液、碘水等试剂。用所提供的试剂检验滤液1中是否含有Fe2+的方法为______________。
(4)向盛有滤渣1的反应器中加入硫酸和H2O2溶液时发生反应的化学方程式为____________.(已知滤渣2中含有S)
(5)某同学称取m1废催化剂进行实验,其中CuS的质量分数为x,实验完成之后,得到m2gCuSO4·5H2O,则铜元素的回收率为________________。(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上期中化学卷(解析版) 题型:选择题
下列有关0.10mol/L的NH4Cl溶液的叙述不正确的是
A.c(H+)>c(OH-) B.c(NH4+)<c(Cl一)
C.c(NH4+) +c(H+) =c(Cl-) +c(OH-) D.c(NH4+)+c(Cl-)=0.10mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上期中化学卷(解析版) 题型:选择题
美国普林斯頓大学的研究人员利用太阳能电池,通过电解的方法成功地将二氧化碳和水转化为甲酸(HCOOH)。下列说法不正确的是
A.CO2是一种温室气体 B.H2O属于非电解质
C.HCOOH是一种一元弱酸 D.HCOOH属于有机物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高一上期中化学试卷(解析版) 题型:推断题
某无色溶液中可能含有:Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+。
①向此溶液中滴加稀HCl无明显现象
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生
③取②的上层清液并加入过量的NaOH溶液,无明显的现象
请回答下列问题:
(1)原溶液中一定含有的离子是_________,一定不含的离子是_________,不能确定是否含有的离子是__________。
(2)②中的离子方程式是____________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高一上期中化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.含金属元素的离子,不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧 化剂
化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学试卷(解析版) 题型:选择题
下列反应的离子方程式表示正确的是( )
A.H2O2溶液与酸性KMnO4溶液反应:2MnO4﹣+3H2O2+6H+═2Mn2++6H2O+4O2↑
B.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3﹣+8H++6I﹣═3I2+2NO↑+4H2O
C.少量SO2通入碳酸钠溶液中:CO32﹣+SO2═CO2+SO32﹣
D.0.01 mol•L﹣1 NH4Al(SO4)2溶液与0.02 mol•L﹣1 Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3•H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com