
| A. | ①②③④ | B. | ②③④① | C. | ②①③④ | D. | ④②③① |
分析 一小块金属钠久置在潮湿的空气中,由于钠和氧气反应生成Na2O,Na2O进而和水反应生成NaOH,NaOH和空气中CO2反应生成Na2CO3,最后以稳定的形态存在.
解答 解:一小块金属钠久置在潮湿的空气中,Na易和空气中氧气反应生成Na2O,钠表面变暗,发生:4Na+O2=2Na2O,
Na2O进而和水反应生成NaOH,发生:Na2O+H2O=2NaOH,生成白色块状固体,生成的氢氧化钠发生潮解,
NaOH和空气中CO2反应生成Na2CO3,发生:2NaOH+CO2=Na2CO3+H2O,
Na2CO3比NaHCO3稳定,最后易稳定的Na2CO3形态存在,最终生成白色粉末,
所以现象是②③④①,
故选B.
点评 本题考查钠的性质,题目难度不大,注意Na2CO3比NaHCO3稳定,注意④的反应为学生解答中易错点和难点.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
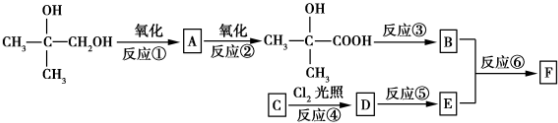
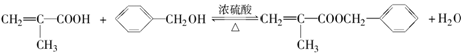 .
.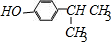 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
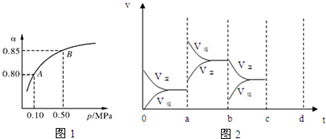
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
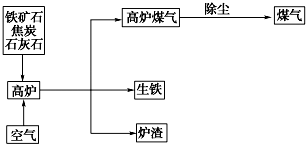
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
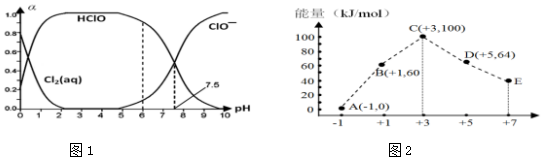
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com