
| A. | AlCl3溶液容易导电 | B. | AlCl3水溶液呈酸性 | ||
| C. | 熔融AlCl3不能导电 | D. | AlCl3溶于水可以电离出Al3+和Cl- |
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
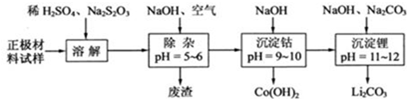
| A. | 在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生的反应8LiCoO2+Na2S2O3+11H2SO4═4 Li2SO4+8CoSO4+Na2SO4+11H2O | |
| B. | 调整pH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去 | |
| C. | Co(OH)2沉淀完全后,溶液中不存在Co2+ | |
| D. | Li与Mg在周期表中处于对角线位置,性质有相似性,因此单质Li可用电解法回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 安徽合肥大麻饼 | B. | 湖北武汉热干面 | C. | 湖南长沙臭豆腐 | D. | 山西杏花村汾酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青霉素G是一种良效广谱抗生素 | |
| B. | 青霉素在使用前不需要做皮肤敏感试验 | |
| C. | 青霉素在体内经酸性水解后,得到青霉氨基酸 | |
| D. | 青霉素的结构骨干中均有青霉酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作食品干燥剂 | |
| B. | 二氧化硅可制成石英坩埚 | |
| C. | 单质硅可用于制光导纤维 | |
| D. | 硅酸钠溶液浸泡木材可起到防火作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com