
| A. | 3mol | B. | 1.5mol | C. | 2mol | D. | 4mol |
科目:高中化学 来源: 题型:选择题
| A. | △H1 | B. | △H2 | C. | △H3 | D. | △H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅在常温下可以和氢气发生反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量最高 | |
| C. | 硅和任何酸都不反应 | |
| D. | 硅在电子工业上是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 25 | 170 | 230 | 400 | 450 | 700 |
| 质量/g | 1.00 | 0.88 | 0.76 | 0.76 | 0.27 | 0.27 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| C. | 0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 | |
| D. | 0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
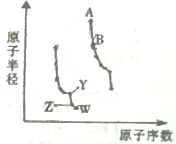 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收过量SO2气体:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | FeI2溶液中通入C12至Fe2+恰好完全被氧化:2Fe2++C12═2Fe3++2C1- | |
| C. | NH4HCO3溶液与过量的NaOH溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2、CO2均属于大气污染物 | |
| B. | 酸雨是pH小于5.6的降水 | |
| C. | CO2也会导致酸雨的形戒 | |
| D. | 大气中O2含量的增加会导致温室效应加剧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com