
| A. | 乙一定是弱碱 | B. | 甲一定是强碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
分析 确定pH=12的碱溶液甲中和pH=11的碱溶液中氢氧根离子浓度关系,用等浓度的盐酸中和时,若两者都是强酸,则消耗的盐酸的量的关系和氢氧根离子浓度关系是一样的,根据消耗盐酸的体积来进行相应的判断即可.
解答 pH=12的碱溶液甲中氢氧根离子浓度是0.01mol/L,pH=11的碱溶液中氢氧根离子浓度是0.001mol/L,甲中氢氧根离子浓度是乙中的10倍,用等浓度的盐酸中和时,若两者都是强酸,则消耗的盐酸甲是乙的10倍,V甲=10V乙此时消耗盐酸的体积为2V甲=V乙,即此时乙消耗的盐酸多,所以乙一定是弱碱.
故选A.
点评 本题考查学生电解质的电离以及pH的有关计算知识,注意知识的迁移应用是关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的物质的量之比为1:14 | |
| B. | Cl2是该反应的氧化产物 | |
| C. | 当转移0.2mol电子时,被氧化的还原剂的物质的量为0.2mol | |
| D. | 由此反应可知还原性HCl>CrCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中加入氢氧化钠溶液,先有白出现,后白色沉淀逐渐消失 | |
| B. | 将铜片放人氯化铁溶液,钢片表面生成银白色的铁 | |
| C. | 在氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现 | |
| D. | 将铜粉加人冷的浓硝酸中会发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将移液管里下端残液吹入锥形瓶 | |
| B. | 滴定时向锥形瓶中加入少量的蒸馏水后继续滴定 | |
| C. | 滴定管用蒸馏水洗涤后未用标准碱液润洗就装入标准碱液进行滴定 | |
| D. | 用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增加了 | ||
| C. | 物质B的质量分数减少了 | D. | b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
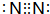 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com