
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |
分析 配合物中內界原子不能发生电离,外界离子在水溶液里能发生电离,氯离子可以与银离子反应生成氯化银白色沉淀,根据沉淀情况可以得到有几个离子在配合物中.Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的$\frac{2}{3}$,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子.
A.绿色晶体配位数是6,含2个氯离子,配体是氯离子和水,它们物质的量之比为1:5;
B.紫色晶体中含3个氯离子,配合物的化学式为[Ti(H2O)6]Cl3;
C.两种晶体分子式均为TiCl3•6H2O,用过量AgNO3处理,沉淀量不同,结构不同,所以性质不同;
D.紫色晶体中含3个氯离子,0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到0.03mol沉淀.
解答 解:配合物中內界原子不能发生电离,外界离子在水溶液里能发生电离,氯离子可以与银离子反应生成氯化银白色沉淀,通过沉淀的质量可以推断出氯离子的含量,原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的$\frac{2}{3}$,两种晶体的组成皆为TiCl3•6H2O,说明紫色晶体中有三个自由移动的氯离子,而绿色晶体中只有2个自由移动的离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中须有五个水,即化学式为[TiCl(H2O)5]Cl2•H2O,而紫色晶体的化学式为[Ti(H2O)6]Cl3,
A.绿色晶体分子式为TiCl3•6H2O,配位数是6,含2个氯离子,化学式为[TiCl(H2O)5]Cl2•H2O,配体是氯离子和水,它们物质的量之比为1:5,故A正确;
B.紫色晶体中含3个氯离子,配位数是6,化学式为[Ti(H2O)6]Cl3,故B正确;
C.两种晶体分子式均为TiCl3•6H2O,用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的2/3,沉淀量不同,结构不同,所以性质不同,故C正确;
D.配合物中內界原子不能发生电离,外界离子在水溶液里能发生电离,紫色晶体中含3个氯离子,紫色晶体的化学式为[Ti(H2O)6]Cl3,0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到0.03mol沉淀,沉淀为m=nM=0.03mol×143.5g/mol=43.05g,故D错误;
故选D.
点评 本题考查配合物,注意配合物内界与外界区别:配合物中外界离子在水溶液里能发生电离,內界原子不能发生电离,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 两种元素构成的共价化合物分子中的化学键一定都是极性键 | |
| B. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性分子中,一定含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
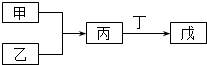 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )| A. | 若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物 | |
| B. | 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 | |
| C. | 若丙、丁混合产生大量白烟,则乙可能具有漂白性 | |
| D. | 若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键有方向性和饱和性,属于共价键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 范德华力是一种分子间作用力,也是一种特殊的化学键 | |
| D. | 常温常压下,卤素单质从F2→I2由气态、液态到固态的原因是范德华力逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
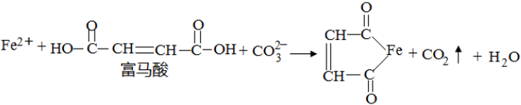

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
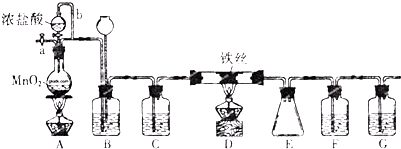
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com