
| A. |  检验装置气密性 | B. |  收集气体 | ||
| C. |  验证苯中不含有碳碳双键 | D. |  实验室制取并收集氨气 |
分析 A.气体可从长颈漏斗逸出,不能检验气密性;
B.导管过短,上下移动量筒时气体可能逸出;
C.苯与溴水、高锰酸钾均不反应;
D.反应生成水,水易倒流.
解答 解:A.气体可从长颈漏斗逸出,不能检验气密性,可将图中长颈漏斗改为分液漏斗,再利用微热法检验气密性,故A错误;
B.导管过短,上下移动量筒时气体可能逸出,则导管伸入量筒较长,便于量筒的移动,防止气体逸出,故B错误;
C.苯与溴水、高锰酸钾均不反应,可验证苯中不含有碳碳双键,故C正确;
D.反应生成水,水易倒流,则图中试管口应向下倾斜,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及气密性检验、气体体积的测定、有机物的结构及气体的制备实验等,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 装置①常用于互溶但沸点不同的液体混合物的分离 | |
| B. | 用装置②可除去NO2中的NO | |
| C. | 装置③可用于吸收NH3或HCl气体,并防止倒吸 | |
| D. | 装置④可用于制备Fe(0H)2并能 较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| Si3N4 | NaOH | Al(OH)3 | C12H22O11 |
| 制造汽车发动机 | 制肥皂 | 抗酸药 | 做调味剂、防腐剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| ① | 将足量的SO2气体通入装有品红溶液的试管中 | 研究SO2具有漂白性 |
| ② | 向盛有10molAgNO3溶液的试管中滴加几滴NaCl溶液,再向其中滴加几滴Na2S | 比较Ksp(AgCl)与Ksp(Ag2S)的大小 |
| ③ | 测定等物质的量浓度HCl,HNO3的pH | 比较Cl,N的非金属性强弱 |
| ④ | 向2支试管中加入同体积通浓度的H2C2O4溶液,再分别加入同体积不同浓度的酸性KMnO4 | 研究浓度对反应速率的影响 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol氦气含有4nA个质子 | |
| B. | 1molNa2O2与足量CO2充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4LHCHO含有nA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.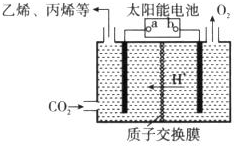
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性 | |
| B. | 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42- | |
| C. | 将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 | |
| D. | 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是应用较为广泛的有色金属.
铜是应用较为广泛的有色金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com