
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
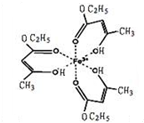 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
16 8 |
17 8 |
18 8 |
1 1 |
2 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
4 2 |
56 28 |
132 50 |
208 82 |
16 8 |
17 8 |
18 8 |
16 8 |
17 8 |
18 8 |
298 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| V | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、Cl-、OH- |
| B、H+、Cu2+、NO3-、SO42- |
| C、Mg2+、SO42-、K+、NO3- |
| D、Na+、MnO4-、Ca2+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和H2SO4属于同类化合物,但它们在水溶液里电离时生成有不同的阴离子,所以它们的化学性质有所不同 |
| B、无氧酸的正盐一定不含氢、氧元素 |
| C、能电离产生氢离子的化合物一定属于酸 |
| D、将Cu(OH)2加入到滴有石蕊试液的蒸馏水中,溶液呈蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com