
室温下,10 mL0.1mol·L-1的氨水加水稀释后,下列说法正确的是
A.溶液的pH增大
B.溶液中NH4+和OH—离子的数目减少
C.NH3·H2O的电离程度增大,c(H+)也增大
D.加入适量盐酸使c(NH+4)=c(Cl—),混合液的pH<7
科目:高中化学 来源: 题型:
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
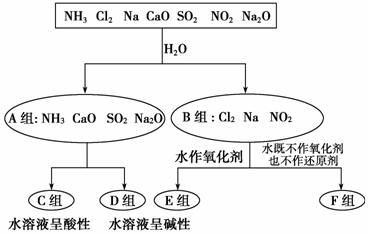
(1)上述第一级分类标准(分成A、B组的依据)是____________________________________________________________________
_________________________________________________________。
(2)F组中物质除了Cl2外,还有________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:________________________________________________________________。
(4)由Al3+制备Al(OH)3最好不选择D组中的NaOH溶液,说明理由:____________________ _________________________________________。
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L的密闭容器中进行下述反应 ,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
1)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有离子交换膜【阴(阳)离子交换膜只允许阴(阳)离子通过】,其工作原理如图所示。

①该电解槽的阳极反应式是 。
②图中a、b两处分别加入的物质是 、 ;离子交换膜为 (填“阴”或“阳”)离子交换膜。
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(2)海洋资源的开发与利用具有广阔的前景,海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
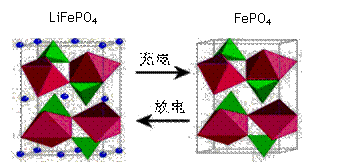
该电池电解质为能传导 Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),电极反应式为 。
(3)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下空气和氯气的体积比为___________________(空气中氧气的体积分数按20%计)。
(4)海水中也含有大量的镁元素,高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如下图,该电池反应的总离子方程式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法中不正确的是
A.苯与氯气在一定条件下可发生取代反应
B.塑料、纤维都是合成高分子材料
C.乙烯、氯乙烯均可使酸性高锰酸钾溶液褪色
D油脂、纤维素和蛋白质在一定条件下都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列针对甲、乙、丙、丁四种实验及装置的说法,不合理的是
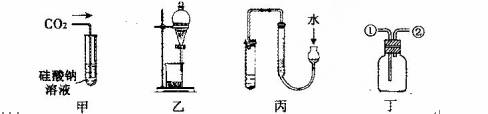
A.甲可用证明碳的非金属性比硅强
B.乙装置可用于碘水中碘的萃取及分液
C.用丙图示的方法检查此装置的气密性
D.丁装置:从①进气可收集NO;从②进气可收集NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
铜-锌原电池如右图所示,下列叙述正确的是 ( )
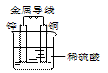
A. 氢离子在负极得电子
B. 锌为负极,发生氧化反应
C. 铜片上无气泡产生
D. 电子从铜片经金属导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
下列试剂中,不能使Fe2+转化为Fe3+的是
①氯气 ②NaCl溶液 ③KMnO 4溶液 ④稀硝酸 ⑤盐酸 ⑥NaNO3溶液
4溶液 ④稀硝酸 ⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④
C.②④⑤ D.②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com