
����Ŀ��ͭ���仯�������������������й㷺Ӧ�ã�ͭ�ڻ������еij������ϼ���+1�ۡ�+2 �ۡ���֪Cu2O��ϡ���ᷴӦ����Һ����ɫ��
��1��������ͭ˿����������ϡ�����У��¶ȿ�����50��,����H2O2,��Ӧһ��ʱ������µ�60�����ٷ�Ӧһ��ʱ�����Ƶ�����ͭ���÷�Ӧ�����ӷ���ʽΪ_______________���¶ȿ�����50��-60��������ԭ����˼ӿ췴Ӧ�����⣬����____________________����CuSO4��Һ�м���һ������Na2SO3��NaCl ��Һ���ȣ�����CuCl������д������CuCl�����ӷ���ʽ________________________________��
��2������Cu��Cu2O ��CuO��ɵĻ�����У�����1L 0.6 mol/L HNO3��Һǡ��ʹ������ܽ⣬ͬʱ�ռ���2240 mL NO ����(��״��)��Cu2O��ϡ���ᷴӦ�����ӷ���ʽ_______________________________�����������������������H2���Ȼ�ԭ�����õ����������Ϊ___________g����������к�0.1mol Cu,���û������ϡ�����ַ�Ӧ����������H2SO4�����ʵ���Ϊ_____________��
���𰸡� Cu+H2O2+2H+=Cu2++2H2O ͬʱ��ֹH2O2 �ֽ� 2Cu2++2Cl-+SO32-+H2O![]() 2CuCl��+SO42-+2H+ 3Cu2O+14H++2NO3-=6Cu2++2NO��+7H2O 16 0.1mol
2CuCl��+SO42-+2H+ 3Cu2O+14H++2NO3-=6Cu2++2NO��+7H2O 16 0.1mol
����������1��.����ͭ˿����������ϡ��������ͭ˿��ϡ�����Ӧ��������H2O2������˫��ˮ����ǿ�����ԣ������������¿���ͭ�����ɶ���ͭ���ӣ���Ӧ�����ӷ���ʽΪ��Cu+2H++H2O2=Cu2++2H2O����ΪH2O2�ڽϸ��¶�ʱ���ֽ⣬�����¶ȿ�����50��-60�棬���Է�ֹH2O2�ֽ⣻��CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ���ȣ�����CuCl������ͭԪ�صĻ��ϼ۽��ͣ���SO32��Cu2+����ΪSO42����Ӧ���Cu2+��Cl��SO32�⣬����H2O��������H+�����ݵ�ʧ�����غ��ԭ���غ���ƽ�ã�2Cu2++2Cl-+SO32-+H2O![]() 2CuCl��+SO42-+2H+���ʴ�Ϊ��Cu+2H++H2O2=Cu2++2H2O��ͬʱ��ֹH2O2�ֽ⣻2Cu2++2Cl-+SO32-+H2O
2CuCl��+SO42-+2H+���ʴ�Ϊ��Cu+2H++H2O2=Cu2++2H2O��ͬʱ��ֹH2O2�ֽ⣻2Cu2++2Cl-+SO32-+H2O![]() 2CuCl��+SO42-+2H+��
2CuCl��+SO42-+2H+��
��2��.ϡ����ɰ�+1�۵�Cu+����Ϊ+2�۵�Cu2+����������ԭΪNO�����ݵ�ʧ�����غ��ԭ���غ㣬�÷�Ӧ�����ӷ���ʽΪ��3Cu2O+14H++2NO3-=6Cu2++2NO��+7H2O��HNO3�����ʵ���Ϊ0.6mol����������������HNO3����ԭΪNO�������ʵ���Ϊ2.24L��22��4L/mol=0.1mol�������������õ�HNO3Ϊ��0.6mol-0.1mol=0.5mol���ⲿ��HNO3ת��Ϊ��Cu(NO3)2������ԭ���غ��֪��ԭ��������Cuԭ�ӵ����ʵ��������������õ�HNO3�����ʵ���֮��Ϊ1��2������H2��ԭ���յõ���Cu������Ϊ��0.5mol��2��64g/mol=16g����������к�0.1 mol Cu�����ݵ�ʧ�����غ�ã�2��0.1mol+2��n��Cu2O��=3��0.1mol��n��Cu2O��=0.05mol��������Ŀ������Ϣ��Cu2O��ϡ���ᷴӦ����Һ����ɫ��˵��������Cu2+�����ӷ���ʽΪ��Cu2O+2H+=Cu2++Cu+H2O����0.05mol Cu2O��ȫ��Ӧ��ҪH2SO40.05mol�� n��CuO��=0.25mol-0.1mol-2��0.05mol=0.05mol��0.05molCuO ��ȫ��Ӧ��ҪH2SO40.05mol�����Թ�����H2SO4�����ʵ���Ϊ0.1mol���ʴ�Ϊ��3Cu2O+14H++2NO3-=6Cu2++2NO��+7H2O��16��0.1mol��


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ����( )
A. ������ͭ��Һ�м��������NaHS��Һ��Cu2++2HS-=CuS��+H2S��
B. Fe3O4�ܽ��ڹ�����ϡ�����У�Fe3O4+8H+=Fe2++2Fe3++4H2O
C. ̼�������Һ������Ŀ��Լ���Һ����ȣ�NH4++OH-![]() NH3��+H2O
NH3��+H2O
D. ������SO2����ͨ��NaClO��Һ�У�SO2+2ClO-+H2O=SO32-+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᣨ�е�118�棩�������������е�77.1�棩�����з����������˵���
A.����B.��ȡC.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ����ͼ���ش��������⣺
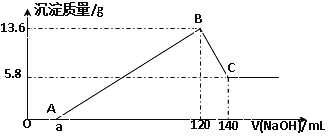
��1��д��OA�κ�BC�η�Ӧ�����ӷ���ʽ��
OA��________________________________ �� BC��_____________________________��
��2��ԭMg-Al�Ͻ��������_____________��
��3��ԭHCl��Һ�����ʵ���Ũ����________________��
��4������NaOH��Һ�����ʵ���Ũ����____________��
��5��a��ֵ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������W��Y����������֮��ΪX��������������2����Z�����������������ڲ��������X��Y��Z�ļ����ӵĵ��Ӳ�ṹ��ͬ��W�ĵ����ǿ��������������������塣����˵����ȷ����
A. Y�����������Գ�ˮ��������Ա�W��ǿ
B. W����̬�⻯���X���ȶ�
C. ���Ӱ뾶�Ĵ�С˳��r(w)>r(X)>r(Y)>(Z)
D. XY2��ZY2�еĻ�ѧ��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪCH4ȼ�ϵ�ص�װ��(A��BΪ���̼��)��
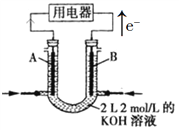
(1)_____(��A��B)���缫���ͨ���飬��缫��ӦʽΪ_____________��
(2)�����ļ�������Ϊ11.2 L(��״����)ʱ������KOH������Ϊ_______g��
(3)Ǧ����������ʹ�õij���أ���Pb��PbO2�����ṹ�ɡ��õ�ع���ʱ�������ĵ缫��ӦʽΪ____________________��
(4)500 mL KNO3��Cu(NO3)2�Ļ����Һ��c(![]() )=6.0 mol��L1����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ���22.4 L����(��״��)���ٶ�������Һ�����Ϊ500 mL��ԭ�����Һ��c(K+)Ϊ_________mol��L1��
)=6.0 mol��L1����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ���22.4 L����(��״��)���ٶ�������Һ�����Ϊ500 mL��ԭ�����Һ��c(K+)Ϊ_________mol��L1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����ɵ�Ӱ�죬���糧��ͼ�������·���������Դ�����ã����»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1��CO ��Cl2�ڴ����������ºϳɹ���(COCl2)��ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2,�ڴ����������·�����Ӧ��CO(g)+Cl2(g)![]() COCl2(g) ;��H=akJ/mol ��Ӧ�����вⶨ�IJ����������±���
COCl2(g) ;��H=akJ/mol ��Ӧ�����вⶨ�IJ����������±���
t/min | n (CO) /mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
����Ӧ1~2minĩ��ƽ������v(COCl2)=________mol/(L��min)��
����2min~4min�䣬vCl2��_______vCO�� (����>������=������<��)�����¶���K=________��
����֪X��L�ɷֱ�����¶Ȼ�ѹǿ����ͼ��ʾLһ��ʱ��CO��ת������X�ı仯��ϵ��
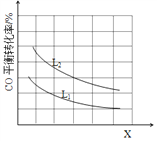
X��������������___________��a_______0 (�>������=������<��)��
��2���ڴ���������NO��COת��Ϊ��������2CO(g) +2NO(g)![]() 2CO2(g) +N2(g);��H=-748kJ��mol-1
2CO2(g) +N2(g);��H=-748kJ��mol-1
��һ�������£���λʱ���ڲ�ͬ�¶��²ⶨ�ĵ�������ת������ͼ1��ʾ���¶ȸ���710Kʱ�����¶ȵ����ߵ�������ת���ʽ��͵�ԭ�������________________________________________________��
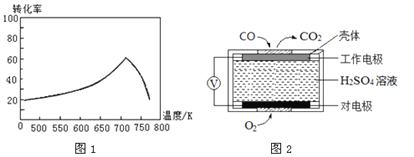
����֪�� �ⶨ������NO��CO�������õķ�����������
����1���绯ѧ������������������CO �������Ĺ���ԭ����ͼ2 ��ʾ�������缫�ķ�ӦʽΪ____________��
����2��������ԭ�ζ�������H2O2��Һ����β��������������ת��Ϊǿ��,������к͵ζ����ⶨǿ�����ȡ�д��NO��H2O2��Һ��Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ��һ���Լ��Ϳ��Լ����Ҵ���������Һ����������Һ�������Լ��ǣ�������
A.NaOH��Һ
B.Na2CO3��Һ
C.ʯ����Һ
D.Cu��OH��2����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���ܺ���Na����Fe3����Br����I����HCO![]() ��SO
��SO![]() ��NO
��NO![]() �����ӡ��������Һ�еμ���ˮ�������ݲ�������Һ�ʳ�ɫ�������ɫ��Һ�м���BaCl2��Һ������ɫ�����������ɫ��Һ�еμӵ�����Һδ���������ڸ���Һ�п϶����ڵ���������(���� )
�����ӡ��������Һ�еμ���ˮ�������ݲ�������Һ�ʳ�ɫ�������ɫ��Һ�м���BaCl2��Һ������ɫ�����������ɫ��Һ�еμӵ�����Һδ���������ڸ���Һ�п϶����ڵ���������(���� )
A. Na����I����SO![]() B. Na����Br����SO
B. Na����Br����SO![]() C. Fe3����Br����NO
C. Fe3����Br����NO![]() D. Na����Br����NO
D. Na����Br����NO![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com