
I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO 3是一个关键步骤 。
(1)某温度下,2SO 2(g)+O 2(g) 2SO 3(g) △H=-197 kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
2SO 3(g) △H=-197 kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是______(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
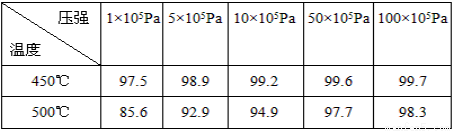
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
(4)能判断该反应达到平衡状态的依据是___________。
A. 容器的压强不变
B. 混合气体的密度不变
C. 混合气体中SO 3的浓度不变
D. C(SO 2)=C(SO 3)
E. v 正(SO 2)=v 正(SO 3)
F. v 正(SO 3)=2v 逆(O 2)
II:研究化学反应原理对于生产生活是很有意义的。
(1)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1mol·L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015-2016学年广东广州执信中学高一上期中考试化学试卷(解析版) 题型:选择题
下列有关0.2mol•L﹣1 BaCl2溶液的说法正确的是
A.1L溶液中Cl﹣离子浓度为0.2mol•L﹣1
B.1L溶液中Cl﹣离子总数为0.2NA
C.1L溶液中Ba2+离子浓度为0.2mol•L﹣1
D.1L溶液中Ba2+和Cl﹣离子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成二氧化硒以回收硒。完成下列填空:
(1) Se和浓硝酸反应的还原产物为一氧化氮和二氧化氮,且一氧化氮和二氧化氮的物质的量比为1:1,写出硒和浓硝酸的反应方程式 。
(2)已知:Se+2H2SO4(浓)→ 2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O → Se+2SO32-+4H+
SeO2、 H2SO4(浓)、 SO2的氧化性由强到弱的顺序是 。
(3)回收得到的二氧化硒的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 → Na2S4O6+2NaI配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量二氧化硒样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中二氧化硒的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(解析版) 题型:填空题
C、N、Na、Cu、O、Si、S、Cl是常见的八种元素。
(1)S在元素周期表的位置是_________________;Cl?的离子结构示意图是__________;Na2O2的电子式____________。
(2)用“>”或“<”填空:
非金属性 | 离子半径 | 热稳定性 | 酸性 |
N____Cl | S2-__Na+ | NH3____H2O | H2SO4__HClO |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1.5mol CuCl(s),放热66.6 kJ,该反应的热化学方程式是_____________________。
(4)气体分子(CN)2的结构式为__________,(CN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:选择题
通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )

A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
查看答案和解析>>
科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
该同学用如下装置进行实验,分析影响反应速率的因素。实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示。
实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
实验Ⅱ(闭合K)1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |

下列说法不正确的是
A.实验Ⅰ中化学能主要转化为热能
B.实验Ⅱ中化学能主要转化为电能
C.反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D.反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ
查看答案和解析>>
科目:高中化学 来源:2016届安徽省合肥市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是 ( )
A. NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AgNO3溶液中
D.SO2通入Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建三明一中高一上学期第二次月考化学卷(解析版) 题型:选择题
下列各组离子能在某无色溶液中大量共存的是
A.HSO3-、H+、MnO4-、K+ B.Cl-、NO3-、Fe2+、H+
C.Ba2+、OH-、Cl-、 Na+ D.NH4+、Na+、NO3-、OH-
Na+ D.NH4+、Na+、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO?简写为Ac?)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
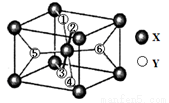
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为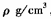 ,XY2的摩尔质量为
,XY2的摩尔质量为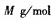 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com