
(1)对于下列反应:2SO2+O2⇌2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),那么2min时SO2的浓度为 .
(2)下图表示在密闭容器中反应:2SO2+O2⇌2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 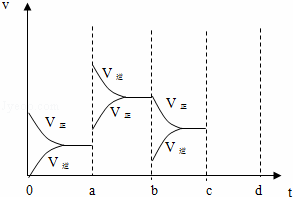
考点:
化学平衡的计算;反应速率的定量表示方法;化学反应速率与化学平衡图象的综合应用.
专题:
化学平衡专题.
分析:
(1)根据v= 计算化学反应速率,根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算二氧化硫的反应速率,速率之比等于化学方程式计量数之比计算氧气反应速率,根据反应速率计算二氧化硫反应量,从而得出2min时SO2的浓度;
计算化学反应速率,根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算二氧化硫的反应速率,速率之比等于化学方程式计量数之比计算氧气反应速率,根据反应速率计算二氧化硫反应量,从而得出2min时SO2的浓度;
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点;
解答:
解:(1)用SO2浓度变化来表示的化学反应速率为v= =
=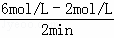 =2mol/(L•min),v(O2)=
=2mol/(L•min),v(O2)= v(SO2)=1mol/(L•min),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(L•min),2min内二氧化硫浓度的变化量为1mol/(L•min)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L﹣2mol/L=2mol/L,
v(SO2)=1mol/(L•min),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(L•min),2min内二氧化硫浓度的变化量为1mol/(L•min)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L﹣2mol/L=2mol/L,
故答案为:2mol/(L•min);1mol/(L•min);2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为,
故答案为:升高温度;减小SO3浓度.
点评:
本题考查化学平衡移动的影响因素,题目难度中等,解答本题的关键是正确判断化学方程式的特征,结合外界条件对平衡移动的影响分析图象.


科目:高中化学 来源: 题型:
下列实验方案设计中,可行的是( )
|
| A. | 用金属钠检验酒精中是否含有水 |
|
| B. | 用AgNO3溶液检验Na2CO3溶液中混有的NaCl杂质 |
|
| C. | 用萃取的方法分离汽油和煤油 |
|
| D. | 用焰色反应区分NaCl和CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
酚醛树脂可用苯酚和甲醛反应制得.实验室制备酚醛树脂时,在酸性条件下,苯酚过量制得酚醛树脂若不易取出,则可趁热时加入一些乙醇来取出酚醛树脂;在碱性条件下,苯酚过量时,若酚醛树脂不易取出时,用加热或加溶剂的方法都很难将酚醛树脂取出.在上述两种情况下,下列有关叙述正确的是( )
|
| A. | 酸性条件制得的是体型结构酚醛树脂,碱性条件制得的是线型结构酚醛树脂 |
|
| B. | 酸性条件制得的是线型结构酚醛树脂,碱性条件制得的是网状结构酚醛树脂 |
|
| C. | 两种条件下制得的都是线型结构的酚醛树脂 |
|
| D. | 两种条件下制得的都是网状结构酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在0.1mol•L﹣1 CH3COOH溶液中,水的离子积是( )
|
| A. | 1×10﹣14 | B. | 1×10﹣13 | C. | 1.32×10﹣14 | D. | 1.32×10﹣15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是弱电解质的是( )
|
| A. | 熔化时不导电 |
|
| B. | 水溶液的导电能力很差 |
|
| C. | 不是离子化物,而是极性共价化合物 |
|
| D. | 溶液中已电离的离子和未电离的分子共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验所对应的离子方程式正确的是( )
A.向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O= Al(OH)3↓+ HCO3-
B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+
C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O
D.加热可增强纯碱溶液去污力:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol•L-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是
(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
 |
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
① 此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
② 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③ 产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以碘酸钾(KIO3)形式存在, 已知在溶液中IO-3可和I-发生反应:IO-3+5I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见物质进行实验,证明食盐中存在IO-3,可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾 淀粉试纸,④淀粉,⑤食糖,⑥食用白醋,⑦白酒进行上述实验时必须使用的物质是 ( )
A.③⑥ B.①③
C.①②④⑤⑦ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
.反应X(g)+Y(g)  2Z(g) ΔH<0,达到平衡时,下列说法正确的是
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com