



科目:高中化学 来源:2013-2014学年福建省厦门市高三质量检查(第一次)理综化学试卷(解析版) 题型:选择题
利用如图装置进行实验,甲乙两池均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是

A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,NO 向B电极移动
向B电极移动
D.断开K1,闭合K2后,A电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
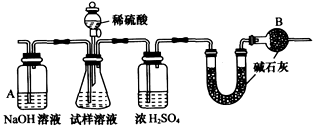
 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________ 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a管发生吸氧腐蚀,b管发生析氢腐蚀 |
| B.一段时间后,a管液面高于b管液面 |
| C.a处溶液的pH增大,b处溶液的pH减小 |
| D.a、b两处具有相同的电极反应式:Fe-2e-=Fe2+ |
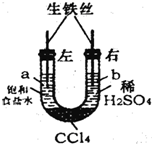
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com