


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
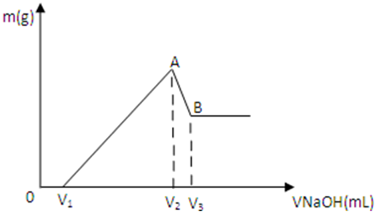 将0.1mol Mg、Al混合物溶于100mL 3mol/L HCl中,再滴加1mol/L NaOH溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:
将0.1mol Mg、Al混合物溶于100mL 3mol/L HCl中,再滴加1mol/L NaOH溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如图,其中OA段无气体产生,回答下列问题.
现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如图,其中OA段无气体产生,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | |
| A | 2 | 1 | 2 | 1 |
| B | 1 | 1 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、①和③ |
| C、①②③ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com