
| | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴化钠溶液(NaI) | 氯水,CCl4 | 萃取、分液 |
| B | 苯(苯酚) | NaOH溶液 | 过滤 |
| C | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| D | 乙醇(乙酸) | 新制生石灰(CaO) | 蒸馏 |
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.甲溶液含有SO42- | B.乙溶液含有SO42- |
| C.丙溶液显酸性 | D.丁溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
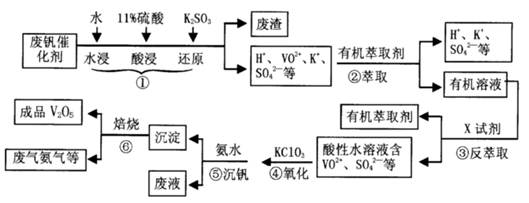
 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去苏打中混有的少量小苏打杂质;除去氯化钠中混有的碘单质 |
| B.分离硝酸钾与氯化钠;分离氯化铁和氯化铜稀溶液 |
| C.除去二氧化碳中混有的少量二氧化硫;除去二氧化碳中混有的少量一氧化碳 |
| D.除去乙醛中溶有的少量乙酸;除去乙醇中溶有的少量苯酚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(CuO) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
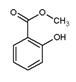 )具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸(
)具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸( )与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )
)与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )| A.NaHCO3溶液 | B.NaOH溶液 | C.Na2CO3溶液 | D.NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
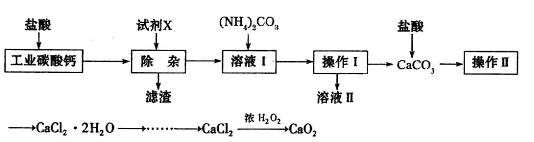
| A.CaO | B.CaCO3 | C.NH3·H2O | D.Ba(OH)2 |
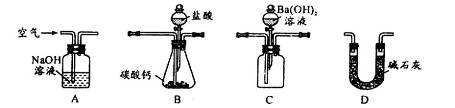
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
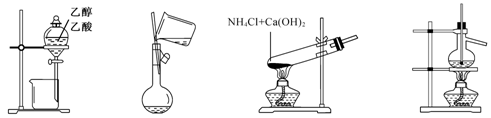
| A.用图1所示装置分离乙醇与乙酸 |
| B.用图2所示的装置向容量瓶中转移液体 |
| C.用图3所示的装置制备少量氨气 |
| D.用图4所示的装置分馏石油 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
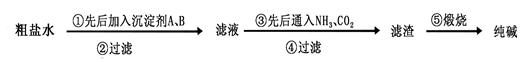
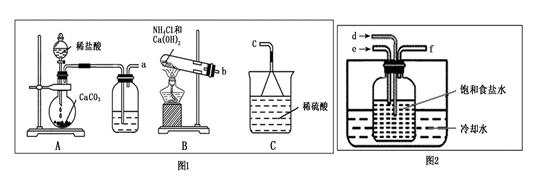
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com