
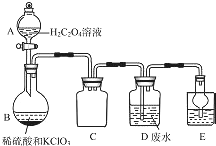
 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:分析 (1)①熟悉仪器的形状说出其名称;依据C装置进气管、出气管都较短可知为安全瓶,防止倒吸;
②稀硫酸、KClO3和草酸溶液制备ClO2,发生氧化还原反应,草酸被氧化为二氧化碳,氯酸钾被还原为ClO2,结合原子守恒、电子守恒配平书写化学方程式;
③二氧化氯具有强的氧化性,能够氧化二价锰离子生成二氧化锰,本身被还原为氯离子;
(2)①加入的指示剂为淀粉,淀粉遇单质碘变蓝,则单质碘反应完,则溶液颜色由蓝色变为无色,达到滴定终点;
②根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
③根据实验操作中滴定液体积大小的影响来回答判断.
解答 解;(1)①A装置的名称是分液漏斗;依据C装置进气管、出气管都较短可知为安全瓶,防止倒吸;
故答案为:分液漏斗; 防倒吸;
②用H2C204溶液、稀硫酸和KC103制备ClO2反应产物为二氧化氯、二氧化碳可稀释Cl02,草酸被氧化为二氧化碳,氯酸钾被还原为ClO2,反应的化学方程式为:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2↑+2ClO2↑+2H2O,
故答案为:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2↑+2ClO2↑+2H2O;
③二氧化氯具有强的氧化性,能够氧化二价锰离子生成二氧化锰,本身被还原为氯离子,离子方程式:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+;
故答案为:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+;
(2)①加入的指示剂为淀粉,淀粉遇单质碘变蓝,则单质碘反应完,则溶液颜色由蓝色变为无色,半分钟不变化说明反应达到滴定终点,
故答案为:加到最后一滴时,溶液的颜色恰好由蓝色变为无色,且半分钟不变化;
②设原ClO2溶液的浓度为x,准确量取ClO2溶液10.00mL,稀释成100.00mL试样,则浓度变为$\frac{x}{10}$,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{x}{10}$V1×10-3mol 1×10-3cV2mol
x=$\frac{2mol×1×1{0}^{-3}c{V}_{2}mol}{10mol×\frac{1}{10}{V}_{1\\;}×1{0}^{-3}mol}$=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=67.5g/mol×$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=$\frac{135c{V}_{2}}{{V}_{1}}$g•L-1,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$;
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则相当于消耗的滴定液的体积偏大,所以测定结果偏大,
故答案为:偏高.
点评 本题考查实验方案的设计,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题关键,题目难度中等.计算时要注意二氧化氯浓度的变化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
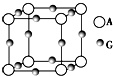 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
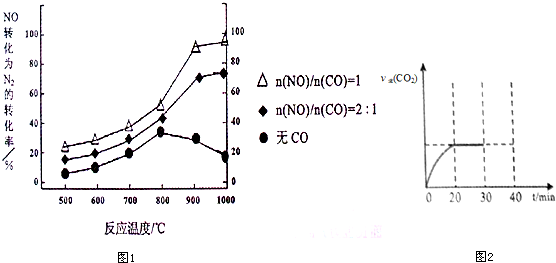
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
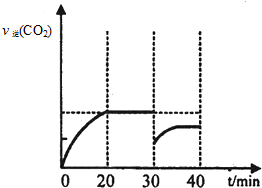 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO${\;}_{4}^{2-}$+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com